كل ما يحتاج المرضى إلى معرفته عن Aduhelm (أدوكانوماب) | دواء الزهايمر الجديد
آخر تحديث 15 مارس 2022

يمكنك الحصول على الأدوية الجديدة بشكل قانوني، حتى لو لم تتم الموافقة عليها في بلدك.
تعلّم كيفمقالة استعرضها الدكتور جان دي ويت
في السابع من يونيو 2021، وافقت إدارة الغذاء والدواء الأمريكية على دواء أدوكانوماب (الذي يُنتج تحت الاسم التجاري "Aduhelm") لعلاج مرض الزهايمر، مما أثار آمال الملايين من مرضى الزهايمر وعائلاتهم حول العالم، بينما أعرب الخبراء عن قلقهم بشأن القرار.
Aduhelm هو أول دواء لمرض الزهايمر توافق عليه إدارة الغذاء والدواء الأمريكية منذ 18 عامًا يدعي هذا الدواء، وفقًا للنتائج المنشورة، أنه قادر على إبطاء تطور مرض الزهايمر نفسه، وليس التخفيف من أعراضه.
كان قرار إدارة الغذاء والدواء الأمريكية بالموافقة على الدواء محفوفًا بالجدل. ومع ذلك، تتوقع شركة Biogen، الشركة المصنعة لدواء Aduhelm البدء في شحن Aduhelm إلى أكثر من 900 مركز رعاية صحية في الولايات المتحدة بحلول نهاية يونيو 2021.
يتوفر عقار Aduhelm حاليًا للمرضى المناسبين خارج الولايات المتحدة على أساس الاستخدام الرحيم أو على أساس مريض محدد. تعرف على المزيد من خلال الانتقال إلى قسم "الوصول إلى Aduhelm خارج الولايات المتحدة".
مرض الزهايمر: إحدى الأزمات الاجتماعية والطبية والاقتصادية الكبرى في القرن الحادي والعشرين
مرض الزهايمر هو اضطراب دماغي تنكسي يصيب اليوم أكثر من 40 مليون شخص حول العالم وهو السبب الأكثر شيوعًا للخرف. وقد اعتُقد لسنوات عديدة أن مرض الزهايمر جزء طبيعي من الشيخوخة، إلا أنه أصبح يُعرف الآن بأنه حالة مرضية ذات آثار صحية واقتصادية واجتماعية خطيرة.
لا يفهم الباحثون حتى الآن أسباب مرض الزهايمر تمامًا، ولكن يُعتقد أنه ناتج عن مجموعة من العوامل، مثل
- الشيخوخة: غالبًا ما يتم تشخيص مرض الزهايمر بعد سن 65 عامًا (مرض الزهايمر المتأخر). يعاني حوالي ثلث الأشخاص الذين تبلغ أعمارهم 85 عامًا فأكثر من داء الزهايمر. يمكن أن تساهم التغيرات في الدماغ المرتبطة بالشيخوخة في الإصابة بهذه الحالة.
- التاريخ العائلي: وجود أحد أفراد العائلة من الدرجة الأولى مصاب بالزهايمر يزيد من خطر إصابة الشخص بالمرض. يعتقد العلماء أن الاستعداد الوراثي يمكن أن يتسبب في الإصابة بمرض الزهايمر المبكر الذي يصيب الأشخاص في الثلاثينيات إلى منتصف الستينيات من العمر. ويصاب 10% فقط من مرضى الزهايمر بالشكل المبكر من المرض.
- عوامل أخرى: وجد العلماء روابط بين التدهور المعرفي وأمراض القلب، وكذلك مرض السكري والسمنة. تربط أقوى الأدلة صحة الدماغ بصحة القلب. كما تم ربط إصابات الرأس بزيادة خطر الإصابة بمرض الزهايمر لأنها يمكن أن تؤدي إلى تكوين لويحات الأميلويد. كما أن الأشخاص الذين يعانون من متلازمة داون، حيث يملي كروموسوم إضافي الترميز الجيني لنوع من بروتين الأميلويد المرتبط بالزهايمر، معرضون لخطر متزايد أيضًا.
يتم تشخيص غالبية الأشخاص المصابين بالزهايمر في المرحلة الخفيفة، عندما تصبح الأعراض أكثر وضوحًا ويكون المرض قد تسبب بالفعل في بعض الأضرار الدماغية، على الرغم من أن بعض الأعراض تبدأ في الظهور حتى قبل عقد من الزمن من التشخيص. قد يتم تجاهل الأعراض المبكرة من قبل المرضى (غالباً بسبب الخجل) أو ببساطة لا يلاحظها الأطباء أو أفراد الأسرة. يبلغ متوسط العمر المتوقع للمرضى من 3 إلى 11 سنة بعد التشخيص.
"مع مرور الوقت، نسيت أمي من أنا"
لمرض الزهايمر ثلاث مراحل مختلفة:
- خفيفة: في المراحل الأولى، يعاني المرضى من فقدان الذاكرة مثل نسيان التواريخ والأحداث المهمة، وتكرار الأسئلة بشكل متكرر، واستغراق وقت أطول لإكمال المهام اليومية، والمشاكل المستمرة في الأمور المالية، وتكرار وضع الأغراض في غير مكانها، والقلق. (لمعرفة المزيد عن مقدار فقدان الذاكرة الطبيعي مع التقدم في العمر، راجع هذا الرسم البياني من قبل المعهد الوطني للصحة التابع للمعاهد الوطنية للصحة (NIH) المعني بالشيخوخة).
- معتدل: مع تقدم المرض، يزداد فقدان الذاكرة والارتباك لدى المرضى، وصعوبة في التواصل والقراءة، وصعوبة في المهام الروتينية مثل ارتداء الملابس، ومشاكل في التعرف على العائلة والأصدقاء، والبارانويا، والهلوسة، والهلوسة، والشرود.
- الحاد: يعاني المرضى المصابون بالزهايمر الحاد من عدم القدرة على التواصل وفقدان الوزن وصعوبة البلع وفقدان السيطرة على الأمعاء أو المثانة. في هذه المرحلة، يلازم المرضى الفراش معظم الوقت ويعتمدون كلياً على الآخرين في رعايتهم.
إن المصاعب التي يواجهها مرضى ألزهايمر رهيبة، حيث يؤثر المرض على كل جانب من جوانب حياتهم اليومية. يمكنك أدناه قراءة بعض القصص التي كتبها المرضى أو أصدقاء المرضى وعائلاتهم.
تحدث ساندي، وهو طبيب أسنان سابق وأستاذ مساعد في جامعة هارفارد، إلى مراسلي شبكة سي إن إن عن إدراكه أن النسيان قد تطور إلى ما هو أسوأ من ذلك: "أنا أنظر في ملف حالة أسنان لمدة ساعة ونصف،" كما يتذكر. 'أنا أقرأه، إنه في دماغي. ثم أغلق الملف ولا أتذكر حرفيًا أي شيء عن الحالة." بعد فترة وجيزة، تم تشخيص إصابته بمرض الزهايمر.
تحدث فريد ووكر، الذي شُخصت إصابة زوجته بمرض الزهايمر، إلى مؤسسة أبحاث الزهايمر في المملكة المتحدة عن زوجته: "'أصبح استخدام الهاتف يفوق قدراتها. لم تستطع التحكم في جميع الأزرار. كان الطباخ معقداً للغاية لدرجة يصعب معها فهمه وكان هناك دائماً خطر تركها للغاز يعمل. لقد وجدت أن إعداد كوب من الشاي أمرًا صعبًا للغاية وكانت تشعر بالارتباك فيما يتعلق بكمية الشاي والحليب والماء المطلوبة."
يصف لوري لجمعية الزهايمر مرض الزهايمر عندما يصل إلى المراحل المتأخرة ويتطور إلى الخرف:
"[...] شرعنا في رحلة جديدة. رحلة تضمنت رعاية على مدار 24 ساعة، وجولات يومية لتناول الأدوية، وضياع أمي تمامًا في ضباب عقلها. [...] لم نستوعب حتى تلك اللحظة عرض الرعب الكامل الذي تنطوي عليه مشاهدة شخص عزيز مصاب بهذا المرض القاسي الخبيث. [...] لقد بدأت تهلوس."
يؤكد مؤسس everyone.org Sjaak Vink كل هذه الأوصاف ويدركها. فقد تم تشخيص إصابة والدته بمرض الزهايمر في عام 2015.
إنه طريق صعب على المرضى وأحبائهم - ولا يقتصر المرض على التأثير على حياتهم الشخصية وحياة أحبائهم فقط.
الضغط على مقدمي الرعاية والميزانيات وصانعي السياسات
يحتاج المرضى الذين يعانون من مرض الزهايمر إلى رعاية متزايدة المتطلبات مع تدهور حالتهم، مثل الرعاية المنزلية أو الرعاية الليلية أو خدمات التدبير المنزلي أو الرعاية التمريضية؛ وفي نهاية المطاف، قد يحتاج المرضى إلى العيش في مرافق المعيشة المساعدة أو دور رعاية المسنين. يُلقي المرض عبئاً ثقيلاً على المريض وعلى أفراد أسرته (الذين غالباً ما يكرسون أنفسهم لرعاية المريض) وعلى ميزانيته الشخصية وميزانية الدولة.
يواجه مقدمو الرعاية الأسرية مهمة صعبة عند رعاية أحبائهم المصابين بمرض الزهايمر. وجدت دراسة استقصائية أن 95% من مقدمي الرعاية الأسرية في المملكة المتحدة يقولون إن ذلك يؤثر على صحتهم البدنية أو العقلية، وأفاد 69% منهم أنهم يشعرون بالإرهاق المستمر، و64% يشعرون بالقلق و49% بالاكتئاب.
في أوروبا، يؤثر مرض الزهايمر وغيره من أشكال الخرف على حوالي 10 ملايين شخص في أوروبا، ومن المتوقع أن يرتفع العدد إلى 14 مليون شخص بحلول عام 2030. تشير التقديرات إلى أن التكلفة الاقتصادية للخرف في أوروبا سترتفع إلى أكثر من 250 مليار يورو بحلول عام 2030، حيث يرجع أكثر من 50% من هذا المبلغ إلى تكاليف الرعاية غير الرسمية. هناك عدم تكافؤ في الحصول على الرعاية والعلاج، ولا سيما في أوروبا الشرقية، وهناك نقص في أنظمة الدعم والبرامج الاجتماعية المتاحة لمرضى الزهايمر ومقدمي الرعاية لهم.
في الولايات المتحدة، دخل مرض الزهايمر مؤخرًا قائمة الأسباب العشرة الأولى للوفيات في الولايات المتحدة، وهو الوحيد من بين الأسباب العشرة الأولى التي لا يوجد لها علاج معروف. وهو يصيب 6 ملايين شخص في الولايات المتحدة ومن المتوقع أن يرتفع العدد إلى 12 مليون شخص بحلول عام 2050. وبحلول نهاية عام 2021، قد تصل التكلفة الإجمالية الوطنية لرعاية المصابين بالزهايمر وغيره من أمراض الخرف إلى 355 مليار دولار أمريكي، ومن المتوقع أن تصل إلى 1.1 تريليون دولار أمريكي بحلول عام 2050.
هذا التمويل، على الرغم من أنه قد يبدو فلكيًا، إلا أنه ضروري لتوفير الدعم الكافي للمرضى، وبقدر الإمكان، حياة كريمة.
ونظراً للرعاية المطلوبة على مدار الساعة، خاصة في المراحل المتأخرة، يتأثر مرضى الزهايمر بشكل خاص عندما تكون الرعاية المقدمة لهم غير كافية، وهو ما يحدث في العديد من البلدان أو المجتمعات. في المملكة المتحدة وحدها، يتم إدخال عشرات الآلاف من المصابين بالخرف إلى غرفة الطوارئ كل عام بسبب العدوى والسقوط والجفاف، والتي تنتج عن عدم كفاية الرعاية. وهذا يزيد من الضغط على ميزانيات الرعاية الصحية الوطنية.
في ظل جائحة كوفيد-19، تضرر مرضى الزهايمر بشدة وعانوا من ارتفاع عدد الوفيات بسبب التقدم في العمر، والحالات الصحية الأخرى طويلة الأمد وتحديات الزهايمر نفسه (مثل مشاكل الذاكرة والارتباك التي تجعل المرضى يعانون من صعوبة في اتباع الإرشادات التي تمنع الإصابة بكوفيد-19).
شعر مرضى الزهايمر في دور الرعاية بالعواقب الوخيمة بطرق أخرى أيضًا. فنظرًا لعدم كفاية الرعاية والانفصال القسري عن أحبائهم من أجل الحفاظ على سلامتهم من كوفيد-19، فإن الوحدة والعزلة التي تلت ذلك قد أدت إلى زيادة تدهور صحتهم النفسية والجسدية.
كما أن هناك حاجة إلى علاجات فعالة للمرض لمنع وصول الأزمات الصحية والاقتصادية إلى أبعاد خطيرة.
النقاط البارزة في أبحاث مرض الزهايمر
في عام 1910، أطلق إميل كرابلين، وهو طبيب في ألمانيا، اسم "داء الزهايمر" على الحالة المرضية "داء الزهايمر" نسبة إلى الطبيب ألويس ألزهايمر، الذي اكتشف السمات المرضية للخرف السابق للمرض لدى مريض يعاني من فقدان عميق للذاكرة وتغيرات نفسية متفاقمة. لم يبدأ البحث عن علاجات لمرض الزهايمر إلا في أواخر الثمانينيات في الولايات المتحدة الأمريكية، لكنه واجه انتقادات حيث كان الأطباء لا يزالون يعتقدون أن الزهايمر نتيجة حتمية للشيخوخة.
في الولايات المتحدة الأمريكية في عام 1978، دخل المعهد الوطني للشيخوخة (NIA) وجمعية الزهايمر في شراكة مع شركة فايزر وبدأت أول تجربة سريرية لدواء يعالج أعراض مرض الزهايمر. تمت الموافقة على الدواء في عام 1993: أدى دواء كوجنيكس (تاكرين)، وفقًا للنتائج المنشورة، إلى تحسين القدرات الإدراكية لدى بعض المرضى، لكنه لم يوقف تفاقم المرض.
على مدار العقد التالي، تمت الموافقة على ستة أدوية أخرى، جميعها لعلاج الأعراض الإدراكية لمرض الزهايمر:
- أريسيبت (دونيبيزيل): لعلاج الأعراض المتعلقة بالذاكرة والتفكير
- رازادين (غالانتامين): لعلاج الأعراض المتعلقة بالذاكرة والتفكير
- إكسيلون (ريفاستيغمين): لعلاج الأعراض المتعلقة بالذاكرة والتفكير
- ناميندا (ميمانتين): لتحسين الذاكرة والانتباه والمنطق واللغة
- نامزاريك (ميمانتين + دونيبيزيل): مزيج مما سبق
- بيلسومرا (سوفوريكسانت): لعلاج الأرق لدى مرضى الزهايمر
تمت الموافقة على آخر دواء تمت الموافقة عليه لعلاج مرض الزهايمر في عام 2003. لعقود من الزمن، اعتُبر مرض الزهايمر نتيجة طبيعية للشيخوخة. وكانت الموارد المخصصة لإيجاد علاج قليلة، حيث كان هناك جدل حول ما إذا كان مرضًا حقيقيًا أم لا. ولكن على مدار العشرين عامًا الماضية، خصص الباحثون موارد وافرة لدراسة المرض وتطوير علاج له.
إن عدم وجود علاجات لمرض الزهايمر لا يرجع إلى إهمال من جانب شركات الأدوية - فقد استثمرت الصناعة بشكل عام المليارات في الأبحاث. فقد أنفقت شركة إيلي ليلي وحدها 4.2 مليار دولار على مدى ثلاثة عقود في محاولة لتطوير دواء ناجح، كما أنفقت المعاهد الوطنية للصحة في الولايات المتحدة أكثر من 500 مليون دولار سنويًا في البحث والتطوير في مجال العلاج.
منذ عام 2013، ضاعف كونغرس الولايات المتحدة الميزانية السنوية للمعاهد الوطنية للصحة في الولايات المتحدة ثلاث مرات لتمويل أبحاث الزهايمر وأمراض الخرف ذات الصلة، لتصل إلى 3.1 مليار دولار في عام 2019.
أدى التمويل الوطني والخاص إلى إجراء 2173 تجربة سريرية في عام 2019 لاختبار نظريات مختلفة. أهم النظريات التي تم اختبارها
- 19% من التجارب ركزت على فرضية الناقلات العصبية
- 17.0% من التجارب اختبرت فرضية شلال الميتوكوندريا والفرضيات الأخرى ذات الصلة
- اختبر 12.7% فرضية انتشار تاو بنسبة 12.7%
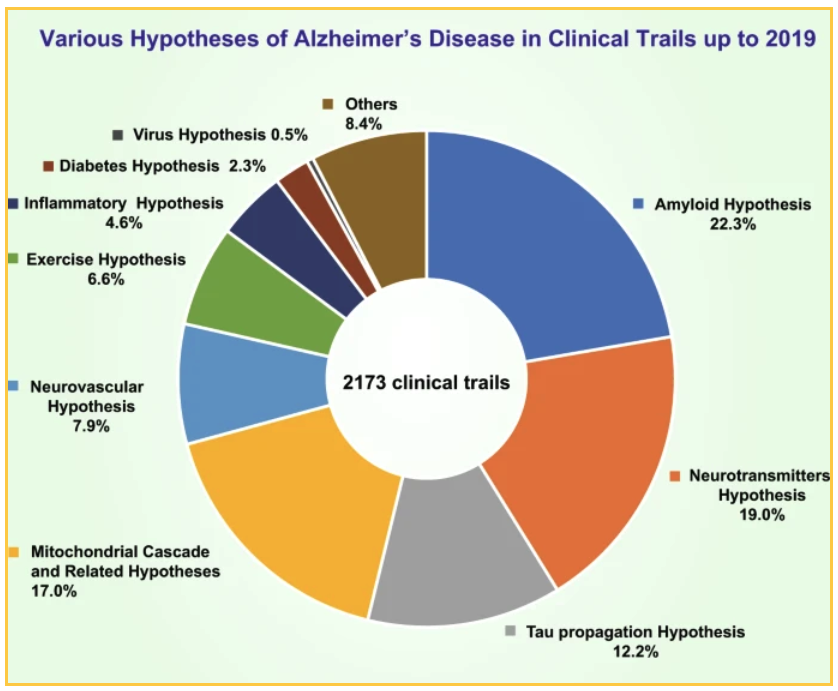
تركز 22.3% من التجارب التي تستهدف الأميلويد على طرق مختلفة لتقليل اللويحات:
- الأجسام المضادة التي يولدها الجهاز المناعي ضد بيتا أميلويد: "اللقاحات النشطة" التي تحفز الجهاز المناعي عند حقنها في الجسم على إنتاج أجسام مضادة لتدمير بيتا أميلويد وتقليل مستويات بيتا أميلويد في الدماغ.
- الأجسام المضادة المنتجة مخبريًا لبيتا أميلويد: "اللقاحات السلبية"، والتي تعتبر أكثر فعالية وأمانًا من محاولة تحفيز إنتاج الأجسام المضادة في الجسم.
- تقليل إنتاج بيتا أميلويد: تغير بعض العلاجات التجريبية سلوك بعض البروتينات التي يمكن أن تمنع أو تقلل من إنتاج بيتا أميلويد.
- منع تجمع بيتا أميلويد: يبحث العلماء عن عقاقير تمنع التفاعلات الأولية بين بيتا أميلويد وخلايا الدماغ التي تؤدي إلى موت خلية الدماغ.
- زيادة إزالة بيتا أميلويد بيتا: تقنيات مثل تعبئة الجهاز المناعي لمهاجمة بيتا أميلويد أو إعطاء عوامل طبيعية ذات تأثيرات مضادة للأميلويد.
- العوامل الطبيعية ذات التأثيرات المضادة للأميلويد: يحتوي الغلوبولين المناعي الوريدي (IVIg) الذي يتم الحصول عليه من المتبرعين بالدم البشري على أجسام مضادة طبيعية يمكنها تقليل مستويات بيتا أميلويد.
ما هو Aduhelm aducanumab-avwa)؟
Aduhelm (أدوكانوماب) هو جسم مضاد مضاد للأميلويد يستخدم لعلاج مرض الزهايمر. وهو مصمم لإزالة لويحات بيتا أميلويد التي تتشكل بين خلايا الدماغ بكميات غير طبيعية لدى مرضى الزهايمر، والتي تؤدي إلى موت خلايا الدماغ المصابة. تم التعرف على بروتين بيتا أميلويد في عام 1984 وسرعان ما تم اعتباره المحفز الرئيسي لتلف خلايا الدماغ، بينما تم التعرف على بروتين تاو في عام 1986، وهو مكون رئيسي للتشابكات ومحفز ثانٍ لتدهور خلايا الدماغ.
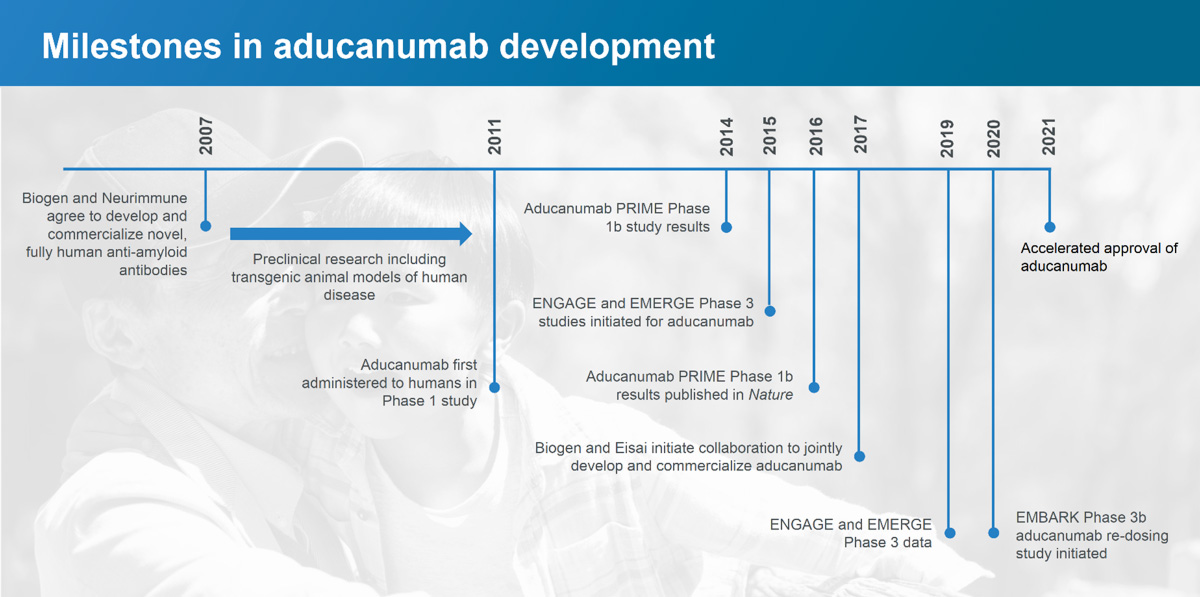
تم تطوير Aduhelm من قبل شركة Biogen، وهي شركة تكنولوجيا حيوية متعددة الجنسيات مقرها في ماساتشوستس بالولايات المتحدة. يُعطى Aduhelm كحقنة شهرية.
لدى Aduhelm تاريخ طويل.
قامت شركة التكنولوجيا الحيوية السويسرية Neurimmune Therapeutics AG، بالتعاون مع جامعة زيورخ، بتحديد الأجسام المضادة الواقية المضادة للأميلويد لدى كبار السن الأصحاء والمرضى الذين يعانون من الخرف البطيء التقدم، وأدى ذلك إلى اكتشاف أدوكانوماب، وهو العنصر النشط في عقار Aduhelm. في المرضى الذين يعانون من مرض الزهايمر الخفيف، فإن الحقن الوريدي الشهري لدواء أدوكانوماب لمدة عام واحد يقلل من لويحات الأميلويد، مما يؤدي إلى تباطؤ التدهور المعرفي.
رخصت شركة Neurimmune عقار aducanumab لعلاج مرض الزهايمر لشركة Biogen في عام 2007، وتعمل بالتعاون مع Biogen على تطويره.
كيف يعمل Aduhelm
يبدو أن مرض الزهايمر ناتج عن التراكم غير المعتاد في الدماغ لبروتينين هما بيتا أميلويد وتاو. بيتا أميلويد هو بروتين موجود عادةً في الدماغ، والذي يتجمع في مرض الزهايمر على شكل لويحات أميلويد بين خلايا الدماغ - وتنص نظرية الأميلويد على أن هذه اللويحات تتلف خلايا الدماغ وتقتلها في نهاية المطاف. يبدو أن لويحات الأميلويد تتطور في وقت مبكر من المرض، في حين أن تشابكات تاو تميل إلى الظهور في وقت لاحق من المرض. ركزت الكثير من الأبحاث التي أجريت لإيجاد علاج لداء الزهايمر على إزالة لويحات الأميلويد.
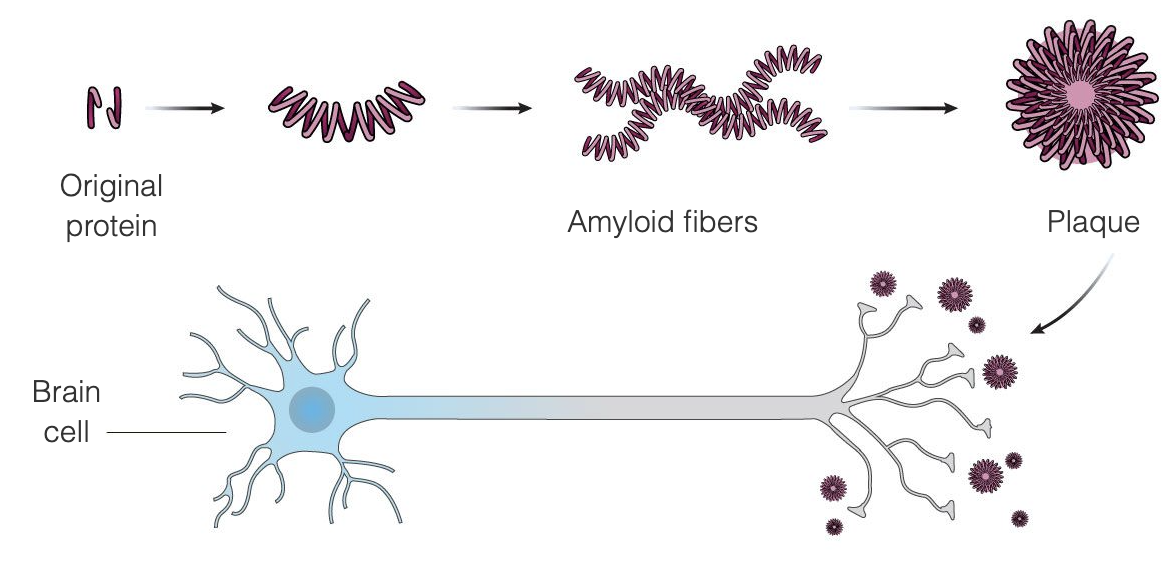
تم تصميم Aduhelm لعلاج مرض الزهايمر في المراحل المبكرة جدًا من المرض عن طريق الارتباط بلويحات الأميلويد، وبالتالي تحفيز الجهاز المناعي لتدمير اللويحات، حيث يعتبرها غازٍ غريب. والهدف من ذلك هو أنه بمجرد إزالة اللويحات، ستتوقف خلايا الدماغ عن الموت وستتوقف الوظيفة الإدراكية عن التدهور. يستخدم " Aduhelm " هذه الآلية بهدف إبطاء تطور المرض، ومخاطبة المرضى في المراحل المبكرة من مرض الزهايمر بشكل خاص. لا يعمل Aduhelm على عكس الضرر الذي حدث بالفعل.
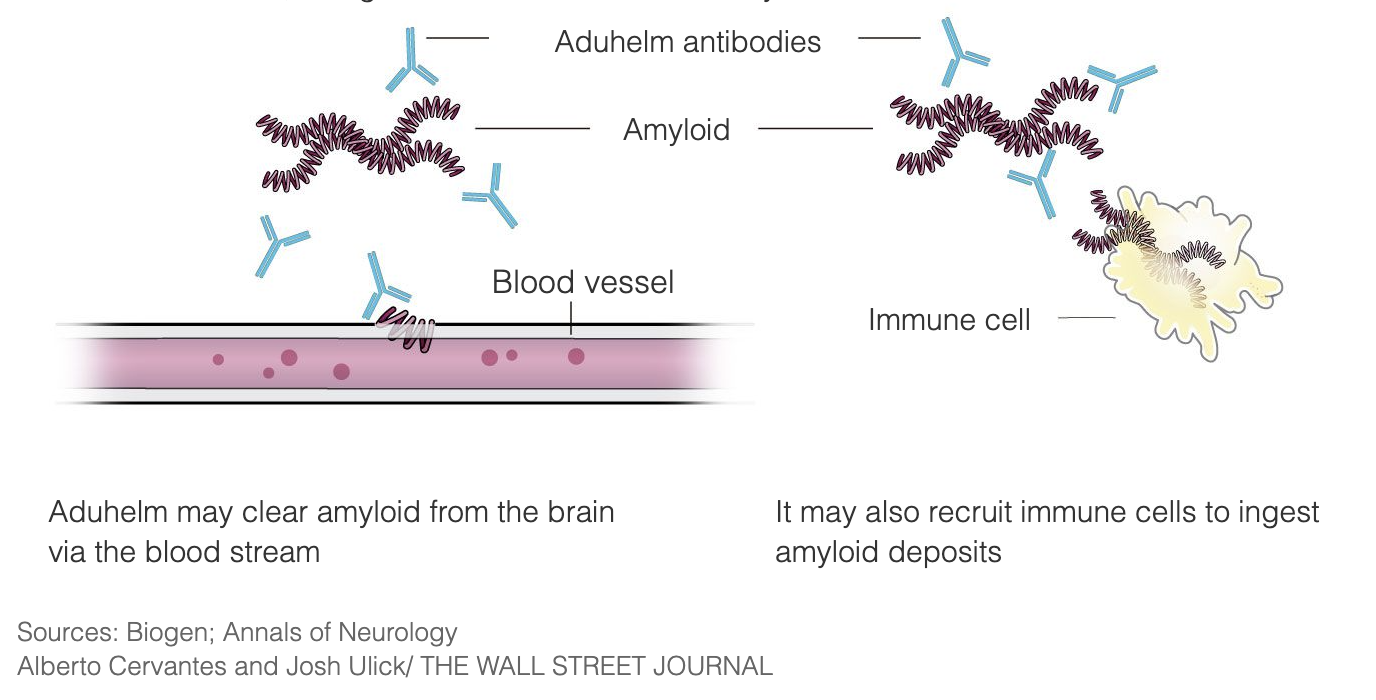
كانت لويحات الأميلويد هدفًا لأبحاث مرض الزهايمر وتطوير الأدوية على مدى 3 عقود، ويعد Aduhelm أحد هذه العلاجات التي تم بحثها على مر السنين.
"كنيسة الأميلويد المقدس"
لم يتفق العلماء بعد على أسباب مرض ألزيمر، ولكن لديهم نظريات معينة. وتسمى إحداها "فرضية الأميلويد" وقد تم تطوير Aduhelm على افتراض صحة هذه النظرية.
وتنص فرضية الأميلويد على أن لويحات الأميلويد التي تتشكل بين خلايا الدماغ تتسبب في موت الخلايا، مما يؤدي إلى التدهور المعرفي. وهي نظرية طويلة الأمد لم يتم قبولها عالميًا - وقد أدى فشل التجارب السريرية التي تستهدف لويحات الأميلويد حتى الآن إلى تشجيع منتقديها. يُطلق البعض على مجموعة مؤيدي النظرية اسم "كنيسة الأميلويد المقدسة" بسبب ترددهم الذي يقترب من رفض النظريات البديلة.
حتى الوظيفة الطبيعية لبيتا أميلويد بيتا في الدماغ، يتنازع الباحثون حولها، حيث لا يتفقون على الدور الطبيعي الذي تلعبه في جسم الإنسان أو ما إذا كانت علامة على مرض ألزيمر فقط.
هناك حجة مضادة شائعة لفرضية الأميلويد وهي وجود لويحات في أدمغة العديد من كبار السن الذين يتمتعون بإدراك طبيعي. ومن المثير للاهتمام أن بعض الفحوصات التي أجريت بعد الوفاة لأشخاص تجاوزوا التسعين من العمر ولديهم ذكريات استثنائية كشفت عن وجود لويحات الأميلويد في أدمغتهم بدرجات متفاوتة - وكان لدى بعضهم كثافة عالية لدرجة أنهم كانوا يشبهون أشد حالات الزهايمر، كما أن لديهم الكثير من الخلايا العصبية أكثر من الأشخاص الذين ماتوا وهم مصابون بالزهايمر.
يعتقد بعض الباحثين أن بيتا أميلويد بيتا يمكن أن يكون له دور وقائي.
يشير جورج بيري، عالم الأحياء العصبية في جامعة تكساس في سان أنطونيو، إلى أن "تراكم بيتا أميلويد وتاو هو في الواقع استجابة وقائية للضغوط الأيضية المرتبطة بالعمر في الخلية"، وهو مفيد بشكل خاص في الحد من الإجهاد التأكسدي في الدماغ (يزداد الإجهاد التأكسدي مع التقدم في العمر، مما يؤدي إلى تلف الخلايا).
بحثت العديد من الدراسات في الأسباب المحتملة الأخرى لمرض الزهايمر. وقد قاد إحدى هذه الدراسات باحثون في كلية إيكان للطب في ماونت سيناي في نيويورك الذين اكتشفوا أن سلالتين من فيروس يسمى HHV (جزء من عائلة فيروس الهربس) توجدان بكميات أكبر في أدمغة الأشخاص المصابين بمرض الزهايمر. وعلى الرغم من أنه ليس من المؤكد أن هذين الفيروسين يسببان المرض (على الأرجح أن السبب هو مزيج من الفيروس بالإضافة إلى متغير جيني معين يسمى APOE)، إلا أن البيانات تشير إلى أن الإصابة بهما تزيد من خطر الإصابة بالزهايمر وأن الأشخاص الذين يعالجون بالأدوية المضادة للفيروسات أقل عرضة للإصابة بالزهايمر بعشرة أضعاف.
ومع ذلك، فإن ما يدعم نظرية الأميلويد هو النتائج الجينية التي تربط بين المشاكل الجينية المرتبطة بالأميلويد وتطور مرض الزهايمر المبكر (لدى الأشخاص الذين تتراوح أعمارهم بين 30 و65 عاماً). تُعتبر متلازمة داون عامل خطر، حيث وجد الباحثون أن الأشخاص الذين يعانون من متلازمة داون لديهم نسخة إضافية من الكروموسوم الذي يحتوي على الجين الذي يرمز لبروتين الأميلويد المرتبط بالإصابة المبكرة بمرض الزهايمر.
قد تؤدي التشوهات الوراثية الأخرى إلى إنتاج متغيرات أطول من بيتا أميلويد التي تشكل لويحات بسهولة أكبر، أو تزيد من إنتاج بيتا أميلويد وتسبب حالات نادرة إلى حد ما من داء الزهايمر المبكر. يمكن أن يحمل العديد من أفراد العائلة الواحدة هذه الطفرات الجينية ويزيد من خطر إصابة الفرد بداء الزهايمر المبكر.
يشير مؤيدو نظرية الأميلويد إلى أن التجارب السابقة التي شملت أدوية استهدفت لويحات الأميلويد كانت ببساطة معيبة. على سبيل المثال، أدت دراسة أجريت على دواء سيماجاسيستات، وهو مثبط لإنتاج بروتينات بيتا أميلويد، إلى تدهور إدراك المشاركين في الدراسة؛ كما لاحظ الباحثون زيادة في سرطان الجلد بين المشاركين. قد يرجع ذلك إلى حقيقة أن السيماجاسيستات قد أدى إلى تثبيط إنتاج بروتينات أخرى أيضًا، وليس فقط بروتين بيتا أميلويد، والتي لبعضها وظائف مهمة في جسم الإنسان.
إن التفسير الأكثر تأييدًا لفشل هذه التجارب التي تستهدف الأميلويدات هو أن الأدوية هي الأدوية الصحيحة، ولكنها تُعطى في المرحلة الخاطئة من تطور مرض الزهايمر - فهي تُعطى في وقت متأخر جدًا في عملية تكوين لويحات الأميلويد، وهي عملية تبدأ قبل عقود من ظهور الأعراض.
يشير مايكل ميرفي، عالم الأعصاب في جامعة كنتاكي، إلى أنه "ربما يكون لدينا بالفعل دواء يمكن أن يعالج مرض الزهايمر، إذا أعطيناه لأشخاص في الخمسينات من العمر".
هناك جدل كبير حول أسباب مرض الزهايمر، ولم يتفق الخبراء بعد على أسباب مرض الزهايمر - لكن المرضى والباحثين قد اكتشفوا نتائج جديدة مع نتائج أدوكانوماب في إحدى التجارب السريرية للمرحلة الثالثة من Aduhelm.
Aduhelm في التجارب السريرية
تُجرى التجارب السريرية على أربع مراحل:
- المرحلة 0: يتم اختبار الدواء بكميات صغيرة جدًا على أقل من 15 مشاركًا للتأكد من عدم ضرره وإمكانية استمرار التجربة.
- المرحلة الأولى: يتم اختبار الدواء على 20 إلى 80 مشاركًا لا يعانون من أي حالات صحية كامنة لضمان عدم وجود آثار جانبية خطيرة. وفقًا لإدارة الغذاء والدواء الأمريكية، ينتقل ما يقرب من 70% من الأدوية إلى المرحلة 2.
- المرحلة 2: يتم اختبار الدواء على عدة مئات من المشاركين الذين يعانون من الحالة التي يهدف الدواء لعلاجها على مدى بضعة أشهر أو سنوات لجمع معلومات حول فعاليته وآثاره الجانبية. ينتقل حوالي 33% من الأدوية إلى المرحلة 3.
- المرحلة الثالثة: يتم اختبار الدواء على ما يصل إلى 3000 مشارك مصاب بالحالة التي يستهدفها الدواء، ويمكن أن يستمر لعدة سنوات. يجب أن يثبت أن الدواء آمن وفعال. تنتقل 25-30% من الأدوية إلى المرحلة 4.
- المرحلة الرابعة: تشمل هذه المرحلة آلاف المشاركين على مدى سنوات عديدة وتجرى بعد موافقة إدارة الغذاء والدواء الأمريكية على الدواء. والغرض منها هو جمع المزيد من المعلومات حول سلامته وفعاليته على المدى الطويل.
Aduhelm في المرحلة 1
أجرت شركة Biogen العديد من التجارب السريرية التي تبحث في عقار أدوكانوماب، بدءًا من ثلاث تجارب للمرحلة الأولى في عام 2011 والتي اختبرت عقار أدوكانوماب على متطوعين أصحاء وعلى مرضى الزهايمر في الولايات المتحدة واليابان، حيث تم العمل بجرعات مختلفة من عقار أدوكانوماب والعلاج الوهمي. تم تسجيل بعض المرضى لأكثر من 3 سنوات.
في عام 2016، نشرت شركة Biogen نتائج المرحلة الأولى من التجارب السريرية التي قام فيها الباحثون بإعطاء حقن وريدية شهرية من أدوكانوماب لمدة عام واحد للمشاركين في التجربة الذين يعانون من مرض الزهايمر الخفيف. وقد انخفضت مستويات بيتا أميلويد في الدماغ لدى المشاركين الذين عولجوا بأدوكانوماب وتباطأ التدهور المعرفي كما تم قياسه من خلال التقييم الرسمي للخرف السريري. من بين المشاركين الذين تلقوا حقن أدوكانوماب، سجل باحثو شركة Biogen أيضًا انخفاضًا في الآثار الجانبية مثل ARIA (تشوهات التصوير المرتبطة بالأميلويد، مثل الوذمة الدماغية أو النزيف في الدماغ). وجدت Biogen أن هذه النتائج مشجعة بما يكفي للمضي قدمًا في المرحلة الثانية.
Aduhelm في المرحلة 2
بدأت بيوجين تجارب المرحلة الثانية في أواخر عام 2018 وقامت بتقييم سلامة الجرعات المستمرة من أدوكانوماب، بالإضافة إلى التحقق من انخفاض لويحات الأميلويد وتباطؤ التدهور المعرفي لدى المشاركين الذين يعانون من المرحلة المبكرة من مرض الزهايمر وأعراضه.
أخفق عقار أدوكانوماب في تحقيق هدفه الأساسي المتمثل في إظهار انخفاض معرفي أبطأ عند علامة 12 شهرًا، ولكن بعد مراجعة بيانات 18 شهرًا من التجربة في إعادة تحليل، لوحظت تأثيرات إيجابية في جرعة واحدة من خمس جرعات - أعلى جرعة من عقار أدوكانوماب. وقد تبين أن الجرعة الأعلى تقلل من لويحات الأميلويد في الدماغ، بالإضافة إلى إظهار استجابات إيجابية على الإدراك.
وقد لوحظت آثار جانبية، كما هو الحال في المرحلة الأولى، مثل تشوهات التصوير المرتبطة بالأميلويد (ARIA) لدى حوالي 10% من جميع المشاركين، وأقل من 15% لدى المشاركين الذين تلقوا أعلى جرعات من أدوكانوماب.
وقال جيف كامينغز، المدير المؤسس لمركز لو روفو لصحة الدماغ في كليفلاند كلينك لو روڤو لصحة الدماغ، في بيان لموقع Biospace: "نتائج تجربة BAN2401 التي استمرت 18 شهرًا مثيرة للإعجاب وتوفر دعمًا مهمًا لفرضية الأميلويد.
Aduhelm في المرحلة 3
بعد نتائج المرحلة الثانية من التجربة، أجرت شركة Biogen تجربتين للمرحلة الثالثة، تسمى Engage وEmerge، والتي شملت أقل من 3300 مشارك مصابين بمرض الزهايمر الخفيف نسبيًا في أمريكا الشمالية وأستراليا وأوروبا وآسيا. تم إعطاء عقار أدوكانوماب مرة واحدة شهريًا بجرعات منخفضة وعالية عن طريق الحقن في مجرى الدم ومقارنتها بنتائج المشاركين الذين تلقوا دواءً وهميًا.
في مارس 2019، أوقفت شركة Biogen دراستي المرحلة الثالثة، مستشهدةً بتحليل عدم الجدوى الذي أجرته لجنة مستقلة لمراقبة البيانات خلصت إلى أن أدوكانوماب لا يبدو أنه يعمل على النحو المنشود.
أثر القرار على 3300 مشارك في الدراسة. تضمنت بروتوكولات المشاركة في الدراسة زيارات متكررة ومطولة وشملت سحب الدم والتصوير بالرنين المغناطيسي والتصوير المقطعي بالإصدار البوزيتروني وأحيانًا البزل الشوكي. بعد سبعة أشهر من إيقاف الدراستين، أعلنت شركة Biogen أن إعادة تحليل البيانات الإضافية أشارت إلى أن الدواء بدا أنه يقلل من التدهور المعرفي عند تناول جرعات عالية.
وكتبت شركة Biogen في بيان صحفي أن البيانات الإضافية تتكون من نتائج مجموعة فرعية من المرضى في دراسة المرحلة الثالثة من Engage الذين تلقوا جرعة عالية من aducanumab وشهدوا انخفاضًا كبيرًا في الإعاقات الإدراكية والوظيفية (الذاكرة والتوجه واللغة)، بالإضافة إلى فوائد الأنشطة في الحياة اليومية (القيام بالأعمال المنزلية والتسوق والسفر بشكل مستقل خارج المنزل). وبناءً على هذه النتائج، تقدمت شركة Biogen بطلب للحصول على الموافقة التنظيمية على عقار أدوكانوماب في أكتوبر 2019 وحصلت عليه في أوائل يونيو 2021.
على الرغم من أن تجارب المرحلة الثالثة من التجارب السريرية لم تكن حاسمة تمامًا بشأن فوائد العلاج فيما يتعلق بالإدراك والوظائف، إلا أن إدارة الغذاء والدواء الأمريكية خلصت إلى أن التجارب أثبتت أن دواء أدوكانوماب، الذي يُنتج تحت الاسم التجاري Aduhelm يمكن أن يقلل من لويحات الأميلويد، وهو ما شكل أساس قرار الموافقة المعجل من إدارة الغذاء والدواء الأمريكية.
كتب فيل غوتيس المشارك في التجربة والمراسل فيل غوتيس لمنصة Being Patient الإخبارية: "لقد علمت من خلال فحص التصوير المقطعي بالإصدار البوزيتروني للدراسة الطولية أنه لم يعد لدي أي أميلويد في دماغي. وقد أكد الفحص، الذي أُجري قبل عامين تقريبًا كجزء من دراسة مجموعة الشيخوخة الدماغية في مركز بنسلفانيا للذاكرة، ما كنت أشك فيه من أن أدوكانوماب يساعدني بالفعل. بدأت أشعر بأنني أخرج من الضباب العقلي المستمر... وعلى الجانب السلبي، لم تعد الذكريات التي فقدتها".
الآثار الجانبية وموانع الاستعمال Aduhelm
وفقًا لدليل الأدوية الخاص بشركة Biogen، يجب على المرضى قبل التفكير في Aduhelm إبلاغ مقدمي الرعاية الصحية بجميع حالاتهم الطبية، بما في ذلك ما إذا كانوا
- حامل أو تخططين للحمل
- ترضعين أو تخططين للرضاعة الطبيعية
يجب أن يخبر المرضى مقدمي الرعاية الصحية عن أي أدوية يتناولونها، بما في ذلك الأدوية التي تُصرف بوصفة طبية أو بدون وصفة طبية والفيتامينات والمكملات العشبية.
وفقًا لدليل الأدوية الخاص بشركة Biogen، فإن التأثير الجانبي الرئيسي المعروف لدواء Aduhelm هو: تشوهات التصوير المرتبطة بالأميلويد (ARIA)، مثل الوذمة الدماغية والنزيف في الدماغ. أما الآثار الجانبية الأخرى فهي
- التفاعلات التحسسية الخطيرة، مثل تورم الوجه أو الشفتين أو الفم أو اللسان والشرى
- الصداع
- الإسهال
- ارتباك/هذيان/تغير في الحالة العقلية/اضطراب في العقل
- السقوط
يُعد أريا أحد الآثار الجانبية الشائعة التي لا تسبب عادةً أي أعراض، ولكنها قد تكون خطيرة. وغالباً ما يظهر على شكل تورم مؤقت في الدماغ يزول عادةً من تلقاء نفسه بمرور الوقت. في الوقت نفسه، تؤدي إزالة الأميلويد من الدماغ إلى إزالة الأميلويد من الأوعية الدموية، مما قد يؤدي إلى ظهور بقع صغيرة من النزيف في الدماغ أو على سطحه.
وقد لوحظت الإصابة بال ARIA لدى 41% من المشاركين في التجارب السريرية الذين تلقوا أدوكانوماب، مقارنة ب 10% من المشاركين الذين تلقوا دواءً وهميًا.
على الرغم من أن معظم الأشخاص الذين يعانون من تورم في مناطق الدماغ لا تظهر عليهم أعراض، إلا أن حوالي 30% من الأشخاص قد يعانون من أعراض خفيفة، مثل
- الارتباك
- الصداع
- الدوار
- تغيرات الرؤية
- الغثيان
شارك دانيال غيبس، طبيب أعصاب متقاعد ومشارك منذ فترة طويلة في تجارب Aduhelm السريرية، تجربته مع أحد الآثار الجانبية النادرة للغاية لعقار ARIA:
"يجب أن أقول أولاً، وهذه هي العقيدة التي هي صحيحة إلى حد كبير، أن [ARIAs] عادة ما تكون حميدة. معظم الناس لا يعرفون أنهم مصابون به. لا يتم اكتشاف [ARIAs] إلا في فحوصات التصوير بالرنين المغناطيسي حيث توجد مناطق صغيرة من التورم أو مناطق صغيرة من ترسب الحديد من النزيف. إذا ظهرت على الأشخاص أعراض بسببها، فإنها عادةً ما تكون خفيفة. الصداع هو الأكثر شيوعاً، وأحياناً الارتباك.
ولكن في أغلب الأحيان، حتى مع وجود أعراض ARIA، إذا توقفت عن تناول الدواء، فستختفي الأعراض في غضون بضعة أشهر. يمكن إعادة تشغيل الدواء مرة أخرى بأمان. كانت هناك حالات قليلة جدًا، على الأقل التي ناقشتها الشركة المصنعة للدواء Biogen، [من] حالات ARIA كارثية أو خطيرة من حالات ARIA، وحالتي كانت ضمن هذه الفئة. [...]
بدأت أعاني من زيادة في نوبات الصداع. لا يصيبني الصداع بشكل غير مألوف، لذا لم أفكر في الأمر حقًا، لكنه أصبح أكثر تواترًا وربما أكثر حدة بعض الشيء، لكنه لا يزال يخف عن طريق [الأدوية] التي لا تستلزم وصفة طبية. [...]
ثم قبل ليلة أو ليلتين من عيد الميلاد في عام 2017، أصبت بأسوأ صداع في حياتي، من النوع الذي نربطه كأطباء أعصاب بنزيف تحت العنكبوتية، وهو نزيف حاد في الدماغ. قمتُ بقياس ضغط دمي وكان مرتفعًا للغاية وظل مرتفعًا، لذا ظننتُ أنني أعاني من سكتة دماغية.
طلبت من زوجتي اصطحابي إلى غرفة الطوارئ، وبحلول الوقت الذي وصلت فيه إلى المستشفى المحلي، لم أستطع حقًا إعطاء تاريخ متماسك. [...]
ولكن في غضون أيام قليلة تحسنت حالتي قليلاً. اختفى الصداع، لكن ما زلت أعاني من صعوبة في القراءة. وخلال الشهر التالي، ازداد الأمر سوءاً قليلاً. أظهرت فحوصات الرنين المغناطيسي في ذلك الوقت أن هذا كان مرضاً أريا (ARIA) مع وجود تورم ونزيف في جميع أنحاء دماغي. ونظرًا لازدياد حدة المرض، فقد كان هناك شعور بضرورة علاجه. وتلقيت خمس جرعات من الستيرويدات بجرعات عالية مما خفف على الفور من الصداع والارتباك. لكن الأمر استغرق حوالي ستة أشهر حتى اختفى التورم في دماغي تماماً."
في ضوء هذه الآثار الجانبية المحتملة النادرة ولكن الخطيرة، سيتعين على مقدمي الرعاية الصحية للمرضى إجراء فحوصات التصوير بالرنين المغناطيسي (MRI) قبل وأثناء العلاج Aduhelm للتحقق من وجود ARIA.
الموافقة على Aduhelm (أدوكانوماب)
في السابع من يونيو 2021، منحت إدارة الغذاء والدواء الأمريكية الموافقة المعجّلة على عقار Aduhelm (أدوكانوماب) لعلاج مرض الزهايمر.
الموافقة المعجّلة هي نوع من الموافقة التي يمكن منحها للأدوية التي تظهر تأثيرًا علاجيًا إيجابيًا في التجارب السريرية، قبل تقديم جميع الأدلة القاطعة. يمكن أن ينطبق هذا فقط على الأدوية الخاصة بالحالات الخطيرة التي تسد حاجة طبية غير ملباة؛ وقد تمت الموافقة على آخر دواء تمت الموافقة عليه لعلاج مرض الزهايمر منذ أكثر من 18 عامًا.
تُمنح الموافقة المعجلة بشروط. تطلب إدارة الغذاء والدواء الأمريكية من الشركة المصنعة (Biogen) إجراء تجربة سريرية جديدة للتحقق من الفائدة السريرية للدواء إذا فشلت التجربة في إظهار الفوائد، فقد تسحب إدارة الغذاء والدواء الأمريكية الموافقة على الدواء. أمام شركة Biogen مهلة حتى عام 2029 لإكمال تجربة سريرية أخرى للتحقق من فوائد دواء aducanumab لمرضى ألزهايمر؛ يرى الخبراء أن إجراء تجربة سريرية ثالثة، والتي يمكن إكمالها في غضون عامين، كان من الممكن أن تكون خيارًا أفضل من الانتظار ثماني سنوات لمعرفة ما إذا كان الدواء فعالاً، بينما يخضع المرضى للعلاج المكلف ويأملون في الأفضل.
جدل طبي ذو دلالات مالية
لقد أثار قرار إدارة الغذاء والدواء الأمريكية بالموافقة على عقار أدوكانوماب حيرة الخبراء الذين يقولون إنه لا توجد أدلة كافية على أن Aduhelm علاج فعال لمرض الزهايمر. وقد نصح العديد منهم، بما في ذلك لجنة مستقلة، إدارة الغذاء والدواء الأمريكية بأن الأدلة المتاحة تثير شكوكًا كبيرة في أن أدوكانوماب يمكن أن يبطئ التدهور المعرفي، وناقشوا ما إذا كانت النتائج الإيجابية من دراسة واحدة فقط من دراستين من دراستي المرحلة الثالثة أساسًا كافيًا لموافقة إدارة الغذاء والدواء الأمريكية.
بعد فترة وجيزة من الموافقة، استقال ثلاثة علماء احتجاجًا على اللجنة المستقلة التي قدمت المشورة لإدارة الغذاء والدواء الأمريكية بشأن العلاج، مشيرين إلى عدم وجود أدلة مقنعة. كما انتقدوا قرار إدارة الغذاء والدواء الأمريكية بالموافقة على دواء أدوكانوماب لأي شخص مصاب بالزهايمر، على الرغم من إجراء التجربة على مرضى الزهايمر في مرحلة مبكرة من المرض، وقبول النظرية القائلة بأن تقليل لويحات الأميلويد سيؤدي بالفعل إلى إبطاء الأعراض الإدراكية (على الرغم من عدم توافق المجتمع العلمي حول صحتها).
يمكن أن يكون لقرار إدارة الغذاء والدواء الأمريكية بالموافقة على أدوكانوماب في ظل هذه الشروط عدة تداعيات.
- يمكن أن تتم الموافقة على أدوية أخرى تستهدف لويحات الأميلويد، مثل دواء دونانيماب من شركة إيلي ليلي، بشكل أسرع مما كان متوقعًا في السابق، مما يحفز اهتمام شركات الأدوية بالاستثمار في أدوية الزهايمر أو مواصلة مشاركتها في التجارب الحالية.
- لقد خلق قرار إدارة الغذاء والدواء الأمريكية تصورًا للمرونة التنظيمية التي يمكن أن تحفز شركات التكنولوجيا الحيوية الأخرى على تطوير أدوية للحالات النادرة، وهو الدافع الذي تراجع بعد سلسلة طويلة من فشل التجارب السريرية، خاصة في السنوات الـ 18 بين الموافقات على علاجات الزهايمر.
- الدواء مكلف للغاية حيث يبلغ سعره 56,000 دولار سنوياً، مما يعني أن أسعار التأمين الصحي الخاص قد ترتفع حيث من المتوقع أن تدفع شركات التأمين تكاليفه، كما أنه سيزيد العبء على دافعي الضرائب كجزء من برنامج ميديكير (التأمين الصحي الوطني الأمريكي). يقول البعض إنه قد يكون "مدمرًا" بالنسبة للرعاية الطبية، ليس فقط بسبب تكاليفه الأساسية، ولكن أيضًا لأن العلاج Aduhelm يتطلب تشخيصًا مبكرًا للمرضى عن طريق إجراء عمليات التشخيص المبكر باستخدام الصنبور الشوكي للكشف عن الأميلويد والمراقبة المستمرة باستخدام التصوير بالرنين المغناطيسي (من بين أمور أخرى)، مما يزيد التكاليف بشكل كبير ويضع ضغطًا على الأنظمة الطبية.
كما يُنظر إلى هذه الموافقة على أنها مكسب غير متوقع لشركة Biogen، حيث ارتفعت أسهمها بأكثر من 50%، بينما ارتفعت أسهم شركة Eisai اليابانية الشريكة بنسبة 56%. يتوقع المحللون أن يجني Aduhelm حوالي 10 مليارات دولار من المبيعات، مع الأخذ في الاعتبار أن هناك 6 ملايين شخص مصاب بمرض الزهايمر في الولايات المتحدة وحدها. هذا الدواء مهم لنمو شركة Biogen لأن المنافسة قد أضرت بمبيعات أدويتها - Tecfidera للتصلب المتعدد (MS)، و Spinraza للضمور العضلي الشوكي (SMA).
Spinraza هو دواء آخر في محفظة بيوجين بسعر مرتفع، حيث يبلغ سعره 750,000 دولار للسنة الأولى من العلاج و375,000 دولار سنويًا بعد ذلك.
لا ينتقد الجميع قرار إدارة الغذاء والدواء الأمريكية بالموافقة على Aduhelm
بما أن الزهايمر مرض متقدم، يحتاج المرضى إلى العلاج عاجلاً وليس آجلاً. وقد منحت أخبار قرار إدارة الغذاء والدواء الأمريكية الكثيرين أملاً جديداً، إما أن يكون العلاج ناجعاً لهم أو لأحبائهم، أو أنه سيحفز الشركات الأخرى على العمل لتطوير علاجات أخرى لمرض الزهايمر.
كانت مجموعات الدفاع عن المرضى قد ضغطت بقوة من أجل الموافقة عليه لأنه لا يوجد سوى ستة علاجات أخرى متاحة للمرض المنهك، والتي تعالج الأعراض فقط لبضعة أشهر. في نوفمبر 2020، صوّتت اللجنة الاستشارية لإدارة الغذاء والدواء الأمريكية ضد الموافقة على عقار Aduhelm مما أثار غضب جمعية الزهايمر ثم تحركت الجمعية التي قامت بحملة للتعبير عن دعمها لإمكانيات الدواء والتأكيد على الحاجة إلى الأمل والتقدم.
في يناير 2021، اجتمعت إدارة الغذاء والدواء الأمريكية ومجموعات المرضى في جلسة استماع، حيث كان المرضى ومقدمو الرعاية والأطباء السريريون والمدافعون عن العلاج، حيث قالوا من بين أمور أخرى أن المرضى لا يمكنهم تحمل الانتظار لفترة أطول للحصول على العلاج.
أكد مدير مكتب العقاقير الجديدة في إدارة الغذاء والدواء بيتر شتاين خلال مؤتمر صحفي أن آراء المرضى لعبت دورًا في ذلك. وقال إن إدارة الغذاء والدواء الأمريكية "سمعت بوضوح شديد من المرضى أنهم على استعداد لقبول بعض الشكوك من أجل الحصول على دواء يمكن أن يوفر فائدة كبيرة في منع تطور هذا المرض، والذي كما نعلم جميعًا، يمكن أن يكون له عواقب مدمرة للغاية."
وقالت باتريزيا كافازوني، المديرة بالإنابة لمركز تقييم الأدوية والأبحاث التابع لإدارة الغذاء والدواء الأمريكية، خلال المؤتمر الصحفي نفسه إن "البيانات تدعم المرضى ومقدمي الرعاية الذين لديهم الخيار في استخدام هذا الدواء".
"وقالت الدكتورة ماريا كاريو، الحاصلة على درجة الدكتوراه، كبيرة المسؤولين العلميين في جمعية الزهايمر: "إن موافقة إدارة الغذاء والدواء الأمريكية على هذا الدواء تبشر بعهد جديد في علاج الزهايمر وأبحاثه. "لقد أظهر لنا التاريخ أن الموافقة على أول دواء في فئة جديدة ينشط هذا المجال ويزيد من الاستثمارات في العلاجات الجديدة ويشجع على المزيد من الابتكار."
متى ستتم الموافقة على Aduhelm في أوروبا؟
يتزايد مرض الزهايمر بسرعة باعتباره إحدى الأزمات الطبية والاقتصادية والاجتماعية الكبرى في هذا القرن - وهو مرض يصعب اكتشافه في وقت مبكر، خاصةً في ظل نقص الأخصائيين في أوروبا الذين يمكنهم تأكيد التشخيص. يعاني 9.7 مليون شخص في أوروبا وحدها، اعتبارًا من عام 2018، من مرض الزهايمر وأشكال أخرى من الخرف، ومن المتوقع أن يرتفع عدد المرضى إلى 14 مليون شخص بحلول عام 2030، مما يخلق حاجة ماسة إلى علاجات فعالة.
لم تتم الموافقة على Aduhelm خارج الولايات المتحدة حتى الآن. قدمت شركة Biogen طلبًا للمراجعة التنظيمية في الاتحاد الأوروبي في أكتوبر 2020، وكذلك في اليابان وكندا وأستراليا والبرازيل في نهاية عام 2020.
وفقًا للوكالة الأوروبية للأدوية (EMA)، عادةً ما يستغرق تقييم طلب ترخيص تسويق دواء جديد حوالي عام، وأقل من ذلك إذا تم منح مطور الدواء تقييمًا معجلاً.
في شهر مارس من هذا العام، حصلت منشأة التصنيع التابعة لشركة Biogen في سويسرا التي تبلغ تكلفتها 2 مليار دولار أمريكي على ترخيص ممارسات التصنيع الجيدة (GMP) من الوكالة السويسرية للمنتجات العلاجية (Swissmedic). تخطط شركة Biogen للحصول على موافقة إدارة الغذاء والدواء الأمريكية (FDA) لإنتاج Aduhelm في المنشأة السويسرية في أواخر عام 2021، وتتوقع توريد الدواء لأكثر من مليون مريض سنويًا.
الوصول إلى Aduhelm خارج الولايات المتحدة الأمريكية
Aduhelm معتمد حاليًا من إدارة الغذاء والدواء الأمريكية ومتاح للمقيمين في الولايات المتحدة - وهناك لوائح تسمح باستيراد الأدوية في البلدان التي لم تتم الموافقة عليها حاليًا.
يحق للمرضى الذين يعانون من أمراض مهددة للحياة أو أمراض موهنة الحصول على الأدوية وشرائها واستيرادها بمساعدة أطبائهم المعالجين.
يمكن للمرضى وأطبائهم القيام بذلك على أساس لوائح الاستخدام الرحيم أو لوائح استيراد المريض المسمى، وهو استثناء قانوني من القاعدة العامة التي تنص على أنه لا يمكن عادةً الحصول على دواء ما إلا بعد الحصول على ترخيص/موافقة السوق (أيًا كانت الصياغة التي نستخدمها) في البلد الذي يعيش فيه المريض. يسمح هذا الاستثناء للمرضى بطريقة قانونية وأخلاقية وآمنة بالوصول والحصول على الأدوية التي لم تتم الموافقة عليها بعد في بلدهم.
اقرأ المزيد عن "أساس المريض المسمى" هنا (EMA).
everyone.org ملتزمون بأن يتمكن المرضى وأطبائهم المعالجين من الحصول على أي دواء متاح في جميع أنحاء العالم للحصول على أفضل علاج ممكن. نحن نعمل بشكل متوافق بنسبة 100% مع اللوائح في بلدك إذا كنت خارج الولايات المتحدة. إذا كنت ترغب في قراءة المزيد من التفاصيل، أو الوصول إلى الدواء أو ترغب في الاتصال بفريق الدعم لدينا، يمكنك القيام بذلك هنا.
كم تبلغ تكلفة Aduhelm
أعلنت شركة Biogen أن تكلفة Aduhelm بجرعة المداومة (10 مجم/كجم) للمريض العادي ستبلغ 56,000 دولار سنويًا. وهذا لا يشمل الاختبارات التي يتعين على المرضى إجراؤها قبل العلاج وأثناء العلاج.
تلقت شركة Biogen انتقادات بشأن ارتفاع سعر الدواء سنويًا.
أشار معهد المراجعة السريرية والاقتصادية (ICER) غير الربحي، الذي يحلل أسعار الأدوية، إلى أن السعر السنوي العادل سيتراوح بين 2500 دولار و8300 دولار لكل مريض سنويًا. وفي بيان له، قال معهد ICER إن موافقة إدارة الغذاء والدواء الأمريكية فشلت في حماية المرضى، ويمكن أن تجمع Biogen أكثر من 50 مليار دولار سنويًا "حتى في انتظار الأدلة التي تؤكد حصول المرضى على فوائد فعلية من العلاج".
رد الرئيس التنفيذي لشركة Biogen ميشيل فوناتسوس على الانتقادات بتأكيده على أن سعر الدواء له ما يبرره من خلال القيمة التي سيحققها للمرضى ومجتمع أقل عبئًا من مرض الزهايمر، وأن السعر هو انعكاس "لعقدين من عدم الابتكار". وأضاف: "لقدحان الوقت للاستثمار في العلاج".
في everyone.org لا يمكننا التأثير على السعر الذي تحدده شركة Biogen. نحن قادرون على مساعدة المرضى في الحصول على Aduhelm بالأسعار التالية:
- 1,958.58 يورو للقارورة الواحدة التي تحتوي على 170 ملغم/1.7 مل (100 ملغم/مل)
- 3,046.68 يورو للقارورة الواحدة التي تحتوي على 300 مجم/ 3 مل (100 مجم/ مل)
استفسر هنا لمزيد من المعلومات.
العلاجات القادمة لمرض الزهايمر
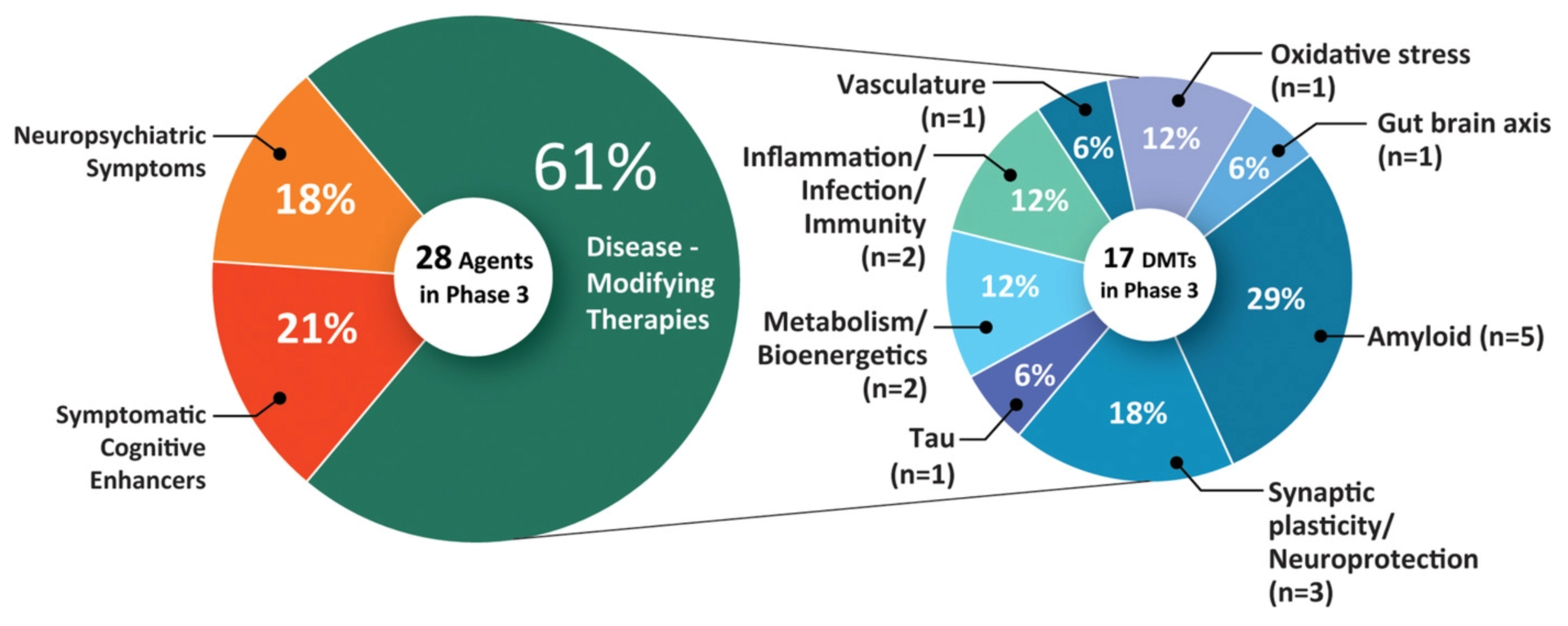
أظهرت دراسة نُشرت في مايو 2021 أن هناك حاليًا 126 علاجًا في التجارب السريريةلمرض الزهايمر. تستهدف 82.5٪ منها تعديل المرض، و10.3٪ منها تعزز الإدراك، و7.1٪ تركز على تخفيف الأعراض العصبية والنفسية.
- تجارب المرحلة 3: 28 علاجًا (بما في ذلك أدوكانوماب)
- تجارب المرحلة 2: 74 علاجًا
- تجارب المرحلة 1: 24 علاجًا
من المرجح أن تتم الموافقة على العلاجات في المرحلة الثالثة من التجارب في العام المقبل.
ليكانماب
ووفقًا للتقارير المنشورة، فإن الجسم المضاد أحادي النسيلة ليكانيماب الذي يعمل بطريقة مماثلة لأدوكانوماب (تحفيز الجهاز المناعي لإزالة لويحات بيتا أميلويد)، يبشر بالخير، وقد انتقل إلى المرحلة الثالثة من التجارب السريرية.
جانتينيروماب
ويرتبط جانتينيروماب بدواء جانتينيروماب مع بيتا أميلويد، وخاصة لويحات بيتا أميلويد مقارنةً بلويحات بيتا أميلويد الفردية التي تدور في الدم. ويُعتقد أنه يعمل على إذابة لويحات الأم يلويد وإزالة بيتا أميلويد عن طريق تحفيز عملية البلعمة، وهي عملية تأخذ فيها الخلية جزيء معين داخلها وتهضمه. أظهرت الدراسات السريرية السابقة لدواء جانتينيروماب أنه يقلل من لويحات بيتا أميلويد لدى الأشخاص الذين يعانون من الشكل الأكثر شيوعًا من مرض الزهايمر الذي لا ينتج مباشرة عن طفرات جينية. وتستمر دراسته في دراستين عالميتين كبيرتين للمرحلة الثالثة.
سولانيزوماب
سولانيزوماب هو جسم مضاد يهدف إلى "تنظيف" بيتا أميلويد من الدم والسائل النخاعي، وبالتالي منع تكون اللويحات. وقد تم الإبلاغ عن الفوائد في المشاركين الذين شاركوا في فترة الثلاث سنوات ونصف السنة الكاملة من التجارب، وأقل من ذلك في المشاركين الذين انضموا في وقت لاحق، لذلك لا يزال هناك المزيد لمعرفة المزيد عن آثاره.
دونانيماب
يبدو أن دونانيماب هو دواء آخر واعد قادم لعلاج مرض الزهايمر. حيث يتم اختباره من قبل شركة إيلي ليلي وشركاه، والتي تخطط لتسجيل 1500 مشارك في دراسة كبيرة من أجل تأكيد نتائج دراستها الأصغر حجمًا؛ حيث استمرت هذه الدراسة السابقة 76 أسبوعًا وشملت 257 مريضًا، ووفقًا للتقارير، أظهرت أن دونانيماب أبطأ بشكل كبير من تقدم مرض الزهايمر.
أخرى
ساراتكاتينيب هو مركب تجريبي يعمل كمثبط لبروتين يسمى فين كيناز الذي يساعد على تكوين لويحات بيتا أميلويد. أظهرت دراسة أُجريت على الفئران أن ساراكاتينيب، من خلال تثبيط بروتين فين كيناز، كان فعالاً في عكس فقدان الذاكرة لدى الفئران. قد يؤدي تثبيط فين كيناز إلى منع أو تأخير تطور المرض.
يعكف الباحثون في معهد سالك للدراسات البيولوجية في كاليفورنيا على دراسة مادة كيميائية تسمى فيسيتين وطوروا نسخة من الفيسيتين تسمى CMS121، ووجدوا أنها فعالة في إبطاء فقدان خلايا الدماغ. يلزم إجراء المزيد من الأبحاث قبل أن يصبح الدواء جاهزاً للموافقة عليه.
وفيما يتعلق بالموافقة الأخيرة على عقار Aduhelmقالت ماريا كارييو، كبيرة مسؤولي العلوم في جمعية الدفاع عن المرضى المصابين بالزهايمر في شيكاغو بالولايات المتحدة الأمريكية، في بيان نشرته مجلة نيتشر: "نحن متفائلون، وهذه هي البداية، سواء بالنسبة لهذا الدواء أو بالنسبة لعلاجات أفضل لمرض الزهايمر."
"كل ما نحن عليه في الحقيقة هو أفكارنا وعقولنا." - ساندي، طبيبة أسنان سابقة وأستاذة مساعدة وأستاذة مساعدة ومريضة بالزهايمر
نحن مقتنعون في everyone.org بأن العلم يدفع بالجنس البشري إلى الأمام ويحسن حياة الناس بل وينقذها. فمرض الزهايمر يهدد جودة حياة الكثيرين. نحن نشجع العلماء الذين يكرسون جهودهم لإيجاد (جزء من) الحل على المثابرة ونتطلع إلى أن تتم الموافقة على العلاجات التي تظهر نتائج واعدة والتي هي قيد التطوير لتصبح متاحة لمرضى الزهايمر في جميع أنحاء العالم في غضون السنوات الثلاث المقبلة.




