موافقة هيئة الدواء الأوروبية على Lurbinectedin: هل هو قادم (ومتى)؟
آخر تحديث 23 أبريل 2024

يمكنك الحصول على الأدوية الجديدة بشكل قانوني، حتى لو لم تتم الموافقة عليها في بلدك.
تعلّم كيفتم تصنيف Lurbinectedin كدواء يتيم من قبل إدارة الغذاء والدواء الأمريكية والوكالة الأوروبية للأدوية. كما تم إدراجه في مشروع أوربيس التابع لإدارة الغذاء والدواء الأمريكية لتسريع الموافقة على دواء الأورام المتزامن 6. كانت هذه كلها بوادر أمل لمرضى سرطان الرئة صغير الخلايا في كل مكان، مما يشير إلى إمكانية تسريع عملية الموافقة على الدواء.
ومع ذلك، بعد مرور أكثر من 5 سنوات على تصنيفه كدواء يتيم وبعد 3 سنوات من موافقة إدارة الغذاء والدواء الأمريكية المعجلة، لا يزال Zepzelca lurbinectedin) ينتظر موافقة الاتحاد الأوروبي.
كم من الوقت لا يزال يتعين على مرضى سرطان الرئة في أوروبا والمملكة المتحدة الانتظار للحصول على هذا العلاج؟ تعرّف على آخر الأخبار، بما في ذلك خياراتك للحصول على lurbinectedin قبل أن يتوفر على نطاق واسع.
ما هو lurbinectedin
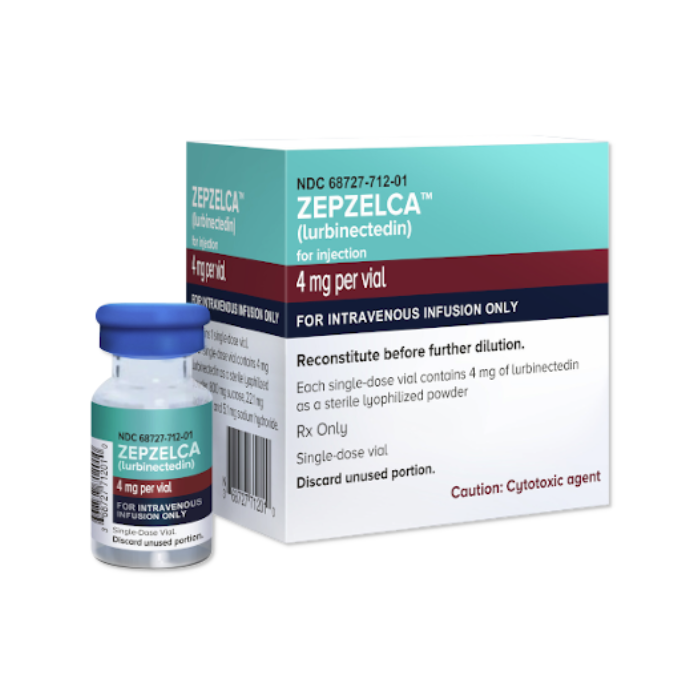
Zepzelca lurbinectedin) هو دواء يُصرف بوصفة طبية لعلاج سرطان الرئة صغير الخلايا النقيلي (SCLC) لدى البالغين. وهو مخصص للمرضى الذين تطور مرضهم بعد العلاج الكيميائي 1.
ما هو معدل نجاح lurbinectedin
منحت إدارة الغذاء والدواء الأمريكية دواء Zepzelca موافقة معجّلة على أساس تجربة PM1183-B-005-14. هذا ما تخبرنا به النتائج المعلنة عن معدل نجاح lurbinectedin في علاج سرطان الرئة الحاد:
-
تقلصت الأورام أو اختفت من 35% من المرضى;
-
كان متوسط مدة الاستجابة 5.3 أشهر;
-
تضمنت بعض التفاعلات الضائرة الأكثر شيوعًا قلة كريات الدم البيضاء وقلة اللمفاويات والإرهاق وفقر الدم وقلة العدلات وزيادة الكرياتينين والألانين أمينوترانسفيراز أو الجلوكوز 1.
Lurbinectedin التجارب التأكيدية
من أجل الحفاظ على موافقة إدارة الغذاء والدواء الأمريكية، طُلب من الشركة المصنعة lurbinectedin إجراء دراسة تأكيدية. فشلت هذه الدراسة التي أُجريت في المرحلة الثالثة، والتي أُطلق عليها اسم ATLANTIS، في إثبات تحسن ملحوظ إحصائيًا في البقاء على قيد الحياة بشكل عام مقارنةً بالعلاج الكيميائي وحده.
ومع ذلك، قد تكون هذه النتيجة بسبب تصميم الدراسة. فعلى سبيل المثال، اختبرت الدراسة جرعة من lurbinectedin أقل من الجرعة المعتمدة من lurbinectedin ودمجته مع عامل العلاج الكيميائي. ومع أخذ ذلك في الاعتبار، قررت إدارة الغذاء والدواء الأمريكية الإبقاء على الموافقة على دواء Zepzelca. من أجل تأكيد فعاليته، يجب على الشركة المصنعة تقديم بيانات من تجربة تأكيدية جديدة بتصميم مناسب.
في الوقت الحالي، لا تزال تجربتان تأكيديتان lurbinectedin جاريتين. ستنتهي تجربة LAGOON في يونيو 2025، وستنتهي تجربة IMForte في مارس 2026. نأمل أن تدعم بيانات هذه التجارب الموافقة على الدواء لفترة طويلة في الولايات المتحدة الأمريكية، وتساعد في تسريع الموافقة عليه في مناطق أخرى، مثل أوروبا.
موافقة هيئة الأدوية الأوروبية على Lurbinectedin: ما هي الحالة؟
في عام 2019، منح الاتحاد الأوروبي للأدوية (EMA) lurbinectedin تصنيف دواء يتيم لعلاج سرطان عنق الرحم 2. ومع ذلك، لم يتم تقديم أي طلب ترخيص تسويق رسمي إلى الوكالة الأوروبية للأدوية منذ ذلك الحين.
عادة، من لحظة تقديم طلب ترخيص التسويق، يستغرق الأمر عادةً ما يصل إلى 210 أيام لاتخاذ قرار الموافقة. قد تكون هذه العملية أسرع قليلاً بالنسبة للأدوية اليتيمة. على أي حال، حتى لو قدمت فارما مار طلب الموافقة من الاتحاد الأوروبي اليوم، فإنها ستظل تتطلع إلى موافقة محتملة في موعد لا يتجاوز نهاية عام 2024 - بداية عام 2025.
الاستثناء من هذا الجدول الزمني هو سويسرا، حيث مُنح الدواء موافقة مؤقتة في مارس 2023 4.
متى سيتوفر lurbinectedin في أوروبا؟
من الصعب الجزم بذلك. إذا تم تقديم طلب موافقة الاتحاد الأوروبي على lurbinectedin قبل نهاية العام، فمن الممكن نظريًا أن يكون هناك قرار بشأنه بحلول منتصف عام 2025. إذا كان إيجابيًا فسيستغرق الأمر 67 يومًا أخرى حتى تصبح موافقة الاتحاد الأوروبي على دواء Zepzelca رسمية.
من تلك النقطة، يمكن لكل دولة عضو في الاتحاد الأوروبي بدء إجراءاتها الخاصة للتفاوض على الأسعار المحلية والسداد وطرحها في السوق المحلية. وتعتمد المدة التي تستغرقها هذه الإجراءات على البلد.
تميل ألمانيا إلى أن تكون الأسرع في إطلاق الأدوية اليتيمة المعتمدة حديثًا، في غضون 102 يومًا في المتوسط. في الطرف الآخر من الطيف نجد إستونيا، حيث يستغرق الأمر في المتوسط 1081 يومًا حتى يصبح الدواء اليتيم الجديد متاحًا 3.
بعبارة أخرى، يبدو أن lurbinectedin سيكون متاحًا في الاتحاد الأوروبي في موعد لا يتجاوز أواخر عام 2025 أو أوائل عام 2026.
متى سيتوفر Zepzelca في المملكة المتحدة؟
منحت هيئة تنظيم الأدوية والمستحضرات الصيدلانية (MHRA) Zepzelca تصنيف الطب المبتكر في عام 2022. وفي العام نفسه، قدمت فارما مار طلبًا رسميًا للحصول على ترخيص تسويق مشروط في المملكة المتحدة 5.
ومع ذلك، لم يتم اتخاذ أي قرارات منذ ذلك الحين. اعتبارًا من أبريل 2024، لم توافق هيئة تنظيم الأدوية والرقابة الصحية على الأدوية بعد على lurbinectedin. كما علّق المعهد الوطني للصحة والبحوث والابتكار والتقييم (NICE) تقييمه للدواء لاحتمال إدراجه في هيئة الخدمات الصحية الوطنية. لا يوجد جدول زمني مقدم من أي من الوكالتين فيما يتعلق بالقرارات.
كيفية الحصول على lurbinectedin بأمان قبل موافقة هيئة تنظيم الرعاية الصحية البريطانية ووكالة الأدوية الأوروبية عليه
هل أنت مريض مصاب بسرطان الخلايا السرطانية السرطانية المزمنة؟ إذا رأى طبيبك أنك قد تستفيد من العلاج بعقار Zepzelca فقد لا تحتاج إلى انتظار الموافقة عليه في أوروبا أو المملكة المتحدة. وبدلاً من ذلك، يمكن أن تفكر أنت وطبيبك في الانضمام إلى تجربة سريرية lurbinectedin . أو شراء الدواء على أساس فردي باسم المريض.
انضم إلى تجربة lurbinectedin السريرية
تتمثل إحدى طرق الحصول على Zepzelca lurbinectedin) في التسجيل في تجربة سريرية. قد يكون قول ذلك أسهل من فعله في كثير من الأحيان، حيث ستحتاج أنت وطبيبك إلى العثور على تجربة تقوم حاليًا بتجنيد مشاركين في بلدك. سيتعين عليك أيضاً استيفاء معايير الأهلية الخاصة بهم. لكل هذا، ستحتاج إلى دعم طبيبك المعالج.
فيما يلي بعض الأماكن الجيدة للبدء في البحث عن تجارب lurbinectedin السريرية الجارية:
-
ClinicalTrials.gov: هذه قاعدة بيانات تضم جميع التجارب السريرية في الولايات المتحدة الأمريكية. بعض التجارب مفتوحة أيضاً للمشاركين الدوليين. مثال على ذلك تجربة LAGOON السريرية. مقرها الولايات المتحدة، ولكنها مفتوحة أيضاً للمرضى في جميع أنحاء أوروبا وآسيا.
-
EUClinicaltrials.eu: هذه قاعدة بيانات تضم جميع التجارب السريرية في الاتحاد الأوروبي. تحتوي حاليًا على معلومات محدودة عن التجارب التي تم إطلاقها قبل 31 يناير 2022. بالنسبة لتلك التجارب، يمكنك الرجوع إلى سجل التجارب السريرية للاتحاد الأوروبي.
-
myTomorrows: تدعم هذه المنظمة المرضى في إيجاد خيارات العلاج في التجارب السريرية.
شراء lurbinectedin كمريض مسمى
في معظم البلدان، يُسمح للمرضى بشراء واستيراد الأدوية التي يمكن أن تحسن من جودة حياتهم أو تعالج الحالات التي تهدد حياتهم. إذا كنت ترغب في الحصول على Zepzelca قبل توفره في بلدك، فقد يكون هذا هو الخيار الأسرع بالنسبة لك ولطبيبك.
وتُعرف اللائحة التي تتيح ذلك باسم لائحة استيراد المرضى الذين يحملون أسماء فردية. قد تكون هناك اختلافات بين البلدان من حيث المتطلبات الإدارية المحددة. ومع ذلك، يجب استيفاء هذه المعايير في جميع الحالات:
-
الدواء المعني حاصل على موافقة السوق في بلد آخر ولم تتم الموافقة عليه (حتى الآن) أو يتوفر في بلد المريض;
-
لا يوجد بديل في السوق المحلي;
-
الدواء للاستخدام الشخصي;
-
لدى المريض خطاب وصفة طبية من الطبيب المعالج;
-
يتحمل الطبيب مسؤولية العلاج. قد يتطلب ذلك وثائق مختلفة من بلد إلى آخر.
هل ترغب في استخدام لائحة استيراد المريض المسمى فرديًا للحصول على lurbinectedin قبل موافقة الاتحاد الأوروبي عليه؟ ستحتاج أولاً إلى استشارة طبيبك المعالج والحصول على وصفة طبية مناسبة.
هل لديك وصفة طبية بالفعل؟ يمكن لفريقنا دعمك في الحصول على Zepzelca. نحن متخصصون في توفير وتوصيل الأدوية غير المتوفرة في بلدك. تواصل معنا لمزيد من المعلومات.
المراجع:
- المعرف المرجعي: 4624945. Accessdata.fda.gov، تم الوصول إليه في 23 أبريل 2024.
- EU/3/19/2143 - التعيين اليتيم لعلاج سرطان الرئة صغير الخلايا. الوكالة الأوروبية للأدوية، 9 أبريل 2019.
- استبيان مؤشر المرضى EFPIA W.A.I.T. استبيان مؤشر المرضى 2021. Efpia، تم الوصول إليه في 23 أبريل 2024.
- فارما مار تعلن عن الموافقة على دواء زيبزيلكا® (lurbinectedin) لعلاج سرطان الرئة صغير الخلايا المنتشر في سويسرا. فارامار، تم الوصول إليه في 23 أبريل 2024.
- تقدمت شركة فارما مار بطلب للحصول على الموافقة على عقار lurbinectedin لعلاج سرطان الرئة صغير الخلايا المنتشر في المملكة المتحدة. فارامار، تم الوصول إليه في 23 أبريل 2024.
- مشروع أوربيس. FDA، تم الوصول إليه في 23 أبريل 2024.