Enhertu لسرطان الرئة: أين تتم الموافقة عليه وكيفية الحصول عليه؟
آخر تحديث 15 يوليو 2024
يمكنك الحصول على الأدوية الجديدة بشكل قانوني، حتى لو لم تتم الموافقة عليها في بلدك.
تعلم كيفEnhertu (fam-trastuzumab deruxtecan-nxki) أحد علاجات السرطان التي يجب مراقبتها ، منذ الموافقة الأولى عليها من قبل إدارة الغذاء والدواء الأمريكية في عام 2019 1.
كما سلامة وفعالية Enhertu في سرطان المبيض وسرطان القولون والمستقيم لا يزال قيد التحقيق ، تمت الموافقة على الدواء بالفعل لعدة مؤشرات. بما في ذلك سرطان الثدي الإيجابي HER2 وسرطان المعدة الإيجابي HER2 وسرطان الثدي المنخفض HER2. وافقت ادارة الاغذية والعقاقير أيضا Enhertu لسرطان الرئة ذو الخلايا غير الصغيرة المتحور HER2. أعطت CHMP في أوروبا مؤخرا رأيا إيجابيا لفعل الشيء نفسه داخل الاتحاد الأوروبي 2.
إذا كنت مريضا بسرطان الرئة في المملكة المتحدة أو في أي مكان آخر خارج الولايات المتحدة الأمريكية والاتحاد الأوروبي ، فربما تتساءل متى Enhertu ستكون متاحة لك أيضا.
إليك كل ما يجب معرفته Enhertu لسرطان الرئة ، وما يمكن أن يتوقعه المرضى في المملكة المتحدة وبقية العالم.
ما هو مؤشر ل Enhertu لسرطان الرئة؟
كعلاج موجه ، Enhertu يهدف فقط إلى علاج السرطانات مع طفرة HER2. على هذا النحو ، ينطبق العلاج على حوالي 2 ٪ من جميع مرضى NSCLC 3.
Enhertu يشار إليه كعلاج وحيد في المرضى البالغين الذين يعانون من NSCLC المتقدم والذين تحتوي أورامهم على طفرة HER2 (ERBB2) نشطة. Enhertu يستهدف المرضى الذين تلقوا علاجا جهازيا مسبقا ، والذين انتشر سرطانهم إلى أجزاء أخرى من الجسم أو لا يمكن إزالته جراحيا 2.
ما هو معدل نجاح Enhertu لسرطان الرئة؟
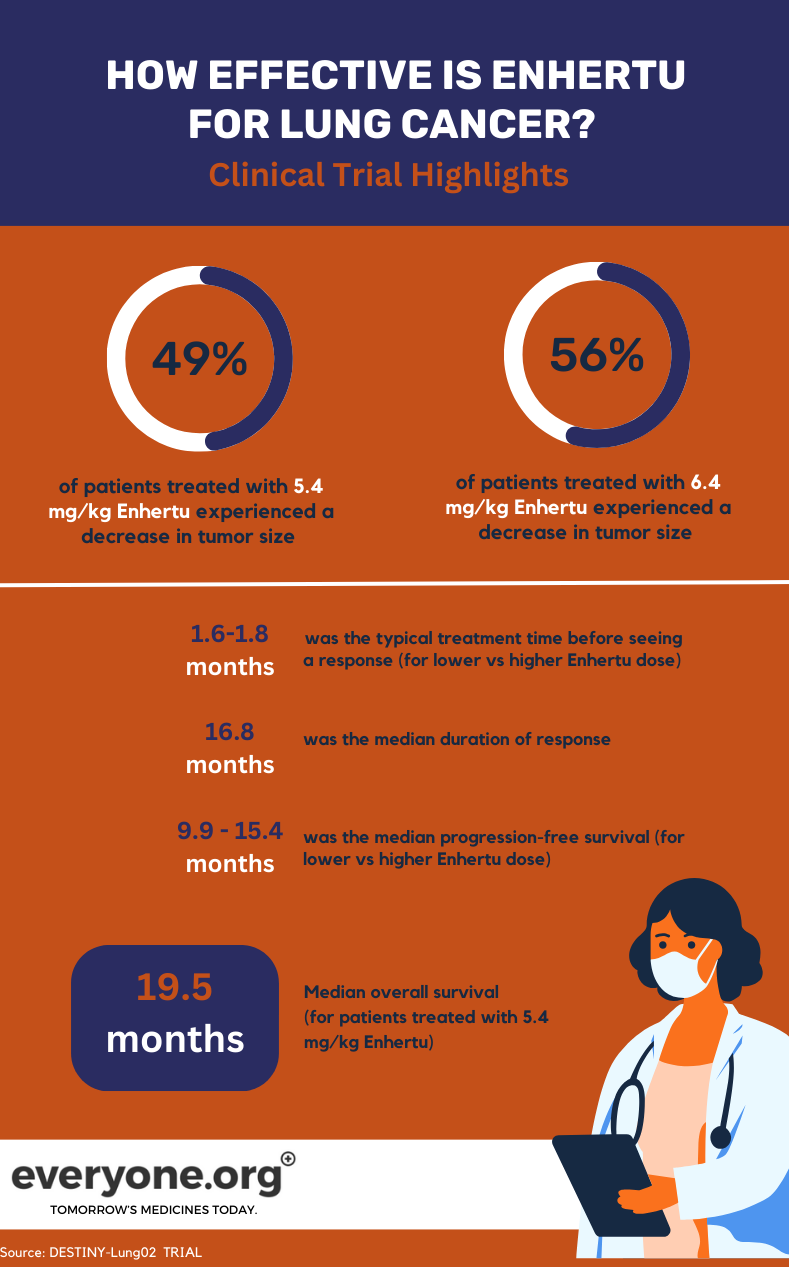
تحقق تجربة المرحلة الثانية من DESTINY-Lung02 الجارية Enhertuالسلامة والكفاءة في معالجة NSCLC المتحور HER2. في التجربة ، جرعتان من Enhertu (5.4 مغ/كغ و6.4 مغ/كغ) قيد المقارنة.
بالنسبة لمرضى سرطان الرئة ، فإن النتائج الأولية الرئيسية من تجربة DESTINY-Lung02 هي:
- تقلصت الأورام ل 49٪ من المرضى الذين عولجوا بأقل Enhertu الجرعة و 56٪ من الذين عولجوا بجرعة أعلى.
- اختفت الأورام تماما ل 1٪ و 4٪ من المرضى في مجموعة الجرعة المنخفضة والأعلى ، على التوالي.
- كان متوسط مدة الاستجابة 16.8 شهرا للمرضى في أقل Enhertu مجموعة الجرعة. بالنسبة للمرضى في المجموعة الأخرى ، تم الإبلاغ عن DoR على أنه غير قابل للتقدير.
- كان متوسط الوقت اللازم لمراقبة الاستجابة الأولية للعلاج 1.8 شهرا و 1.6 شهرا في مجموعة الجرعة المنخفضة والأعلى ، على التوالي.
- كان متوسط البقاء على قيد الحياة بدون تقدم 9.9 شهرا عند 5.4 مغ / كغ ، و 15.4 شهرا عند 6.4 ملغم / كغم 4.
ما هو متوسط البقاء على قيد الحياة Enhertu المرضي؟
للمرضى الذين يتلقون أقل Enhertu في التجربة السريرية ، كان متوسط البقاء على قيد الحياة بشكل عام (OS) 19.5 شهرا. تم الإبلاغ عن نظام التشغيل على أنه غير قابل للتقدير لمجموعة الجرعة الأعلى 4.
ما هي الآثار الجانبية ل Enhertu على الرئتين؟
تم الإبلاغ عن بعض الحالات الشديدة أو المهددة للحياة أو المميتة من مرض الرئة الخلالي (ILD) في Enhertu المرضي. المرضى الذين يعانون من اختلال كلوي معتدل قد يكونون أكثر عرضة 6.
ضمن تجربة DESTINY-Lung02 ، تم الإبلاغ عن ILD في 12.9 ٪ من المرضى في مجموعة الجرعة المنخفضة ، وفي 28 ٪ من المرضى في مجموعة الجرعة الأعلى. ولم تكن غالبية هذه الحالات خطيرة. تم الإبلاغ عن ILD من الدرجة 3 أو أعلى في 2 ٪ من المرضى في كلتا المجموعتين من المرضى.
Enhertuملف تعريف السلامة لسرطان الرئة يشبه أدائه في مؤشرات أخرى. بناء على انخفاض معدل حدوث الآثار الضارة (38.6٪ مقابل 58٪) ، تعتبر جرعة 5.4 مجم / كجم العلاج الأمثل لمرضى NSCLC 4.

أين Enhertu معتمد لسرطان الرئة؟
في الوقت الحالي، تمت الموافقة على Enhertu في الولايات المتحدة الأمريكية والاتحاد الأوروبي وإسرائيل واليابان لعلاج المرضى البالغين الذين يعانون من سرطان الرئة غير صغير الخلايا غير صغير الخلايا غير قابل للاستئصال أو النقيلي الذين لديهم طفرات HER2 (ERBB2) المنشطة 4.
هل Enhertu تمت الموافقة على سرطان الرئة في المملكة المتحدة؟
اعتبارًا من يوليو 2024، ليس بعد. أعلنت مسودة التوجيهات النهائية التي نشرتها NICE في مارس 2024 أن Enhertu لن يكون متاحًا في هيئة الخدمات الصحية الوطنية حتى يتوفر سعر فعال من حيث التكلفة. في هذه الأثناء، للأسف، Enhertu غير متاح في المملكة المتحدة لسرطان الرئة 7.
هل يمكن لطبيبي أن يصف Enhertu لسرطان الرئة إذا لم تتم الموافقة عليه بعد؟
الجواب القصير هو نعم.
Enhertu تمت الموافقة عليه بالفعل في العديد من البلدان لعلاج NSCLC المتحور HER2. بناء على ذلك ، يتمتع طبيبك بسلطة وصف الدواء لهذا المؤشر حتى لو لم تتم الموافقة عليه بعد في بلدك.
عندما يصف الطبيب دواء لعلاج مرض لم تتم الموافقة عليه (حتى الآن) ، وهذا ما يسمى الاستخدام خارج التسمية. قد يكون من الصعب ملء وصفة الاستخدام خارج التسمية في بعض البلدان ، اعتمادا على اللوائح المحلية والتوافر. ومع ذلك ، من الممكن دائما تعبئته باستخدام لائحة استيراد المريض المسمى.
هل اتخذ طبيبك قرارًا بوصف Enhertu لعلاج سرطان الرئة لديك؟ يمكن لفريقنا في www.everyone.org مساعدتك في الحصول على الدواء. نحن متخصصون في توفير وتوصيل الأدوية الموصوفة غير المعتمدة أو غير المتوفرة في بلد المريض. اتصل بنا، حتى نتمكن من مساعدتك.
مراجع:
- ستيوارت ، جوديث. Enhertu (fam-trastuzumab deruxtecan-nxki) تاريخ موافقة ادارة الاغذية والعقاقير. Drugs.com، 15 أغسطس 2022.
- Enhertu. وكالة الأدوية الأوروبية ، تم الوصول إليه في 06 نوفمبر 2023.
- HER2 وسرطان الرئة. جمعية الرئة الأمريكية ، تم الوصول إليه في 6 نوفمبر 2023.
- Enhertu أظهرت استجابات قوية ودائمة للورم في سرطان الرئة المتقدم المتحور HER2 الذي تم علاجه سابقا في تجربة المرحلة الثانية من DESTINY-Lung02. أسترازينيكا، 11 سبتمبر 2023.
- معلومات المشروع | تراستوزوماب ديروكستيكان لعلاج سرطان الرئة غير الحرشفية غير الحرشفية غير صغير الخلايا المتحور HER2 بعد 1 أو أكثر من العلاجات [ID3934] | التوجيه. NICE ، تم الوصول إليه في 6 نوفمبر 2023.
- USPI-DB-04 CDX التحديث النهائي. Daiichi Sankyo، تم الوصول إليه في 6 نوفمبر 2023.
- المملكة المتحدة NICE يرفض Daiichi Sankyo' Enhertu لسرطان الثدي، التكنولوجيا الصيدلانية، تم الوصول إليه في 15 يوليو 2024.