إيقاف علاج ريليفريو: أفضل البدائل وكيفية مواصلة العلاج
آخر تحديث 14 مايو 2024

يمكنك الحصول على الأدوية الجديدة بشكل قانوني، حتى لو لم تتم الموافقة عليها في بلدك.
تعلّم كيفجلب Relyvrio بصيصًا من الأمل لمرضى التصلب الجانبي الضموري في الولايات المتحدة الأمريكية مع موافقة إدارة الغذاء والدواء الأمريكية المعجلة في عام 2022. إلا أن بريق الدواء لم يدم طويلاً. ولم يحصل على موافقة الجمعية الأوروبية للأدوية بعد رفض الدواء مرتين. وفي مارس 2024، فشلت نتائج تجربة PHOENIX في إثبات فعالية Relyvrio بين عدد أكبر من السكان 1.
يبدو أنه من المحتم أن يتم إيقاف ريليفريو. ومع ذلك، هناك أكثر من 4000 مريض في الولايات المتحدة الأمريكية يتناولون العلاج، وربما أكثر من ذلك في جميع أنحاء العالم الذين حصلوا عليه عن طريق استيراد المرضى الذين تم تسميتهم.
إذا كنت واحدًا منهم، فإليك ما يجب أن تعرفه عن تجربة Relyvrio السريرية الفاشلة والبدائل المتاحة لك.
فشل تجربة ريليفريو السريرية: ماذا حدث؟
عندما حصل دواء Relyvrio على الموافقة المعجلة في الولايات المتحدة الأمريكية، أشارت إدارة الغذاء والدواء الأمريكية إلى عدم كفاية الأدلة على أن الدواء يمكن أن يساعد في إطالة فترة البقاء على قيد الحياة أو إبطاء تطور المرض لدى مرضى التصلب الجانبي الضموري 6. ومع ذلك، في ذلك الوقت كانت هناك (ولا تزال) حاجة علاجية واضحة غير ملباة. ولذلك، قررت إدارة الغذاء والدواء الأمريكية المضي قدمًا في الموافقة، بدلاً من انتظار نتائج المرحلة الثالثة من تجربة PHOENIX.
تقدمنا سريعًا إلى بداية عام 2024 وكانت نتائج تجربة PHOENIX مخيبة للآمال، بعبارة ملطفة. بعد 48 أسبوعًا من العلاج، لم يُظهر Relyvrio أي فائدة كبيرة مقارنة بالعلاج الوهمي. تم قياس الفائدة السريرية من خلال التغييرات في مقياس التصنيف الوظيفي لمرض التصلب الجانبي الضموري الجانبي-التنقيح (ALSFRS-R) الدرجة 1.
لم تكن هناك أيضًا فوائد ذات دلالة إحصائية ذات دلالة إحصائية لـ Relyvrio على أي نتائج ثانوية أخرى. وشملت هذه النتائج انخفاض القدرة الحيوية البطيئة، ونوعية الحياة، وانخفاض في مرحلة كينغ وميلانو-تورينو، والبقاء على قيد الحياة بدون تنفس صناعي، والبقاء على قيد الحياة على المدى الطويل 2.
كانت هذه النتائج بمثابة مفاجأة سلبية للعديد من الأطباء والمرضى. خاصة بالنظر إلى نتائج تجربة Centaur، حيث أبطأ Relyvrio من انخفاض درجة ALSFRS-R مقارنةً بالعلاج الوهمي، خاصةً في المهارات الحركية الدقيقة. انخفض خطر الوفاة لدى المرضى الذين عولجوا بعقار "ريليفريو" بنسبة 44%، حيث بلغ متوسط البقاء على قيد الحياة 25 شهرًا مقارنة ب 18.5 شهرًا للمجموعة الضابطة. بعد مرور 24 شهرًا، كان لدى مرضى Relyvrio فرصة للبقاء على قيد الحياة بنسبة 51.6% مقابل 33.9% لمجموعة العلاج الوهمي 7.
ومع ذلك، فإن البيانات هي البيانات. ماذا يحدث بعد ذلك؟
هل يتم سحب Relyvrio من السوق؟
نعم. في 4 أبريل 2024، أعلنت الشركة المصنعة لـ Relyvrio، شركة Amylyx، أنها بدأت عملية سحب Relyvrio من السوق 3. سينطبق إلغاء Relyvrio على كل من الأسواق التي تمت الموافقة عليه فيها - الولايات المتحدة الأمريكية وكندا. وفقًا للبيان الصحفي الصادر عن Amylyx، فإن أي مرضى يتناولون Relyvrio حاليًا ويرغبون في مواصلة علاجهم، سيتم تحويلهم إلى برنامج مجاني 3.
إذا كنت متأثرًا بإزالة Relyvrio من السوق، فإليك بعض الخيارات والبدائل المتاحة أمامك.
ما هي بدائل Relyvrio الخاصة بك؟
إذا كنت أنت أو أحد أحبائك تتناول دواء Relyvrio، فلا بد أن خبر فشل تجربته السريرية أمر يصعب التعامل معه. خاصة إذا كنت قد رأيت نتائج جيدة معه.
ومع ذلك، هناك بعض الإجراءات التي يمكنك اتخاذها. وكلها تتطلب مناقشة مع الطبيب المعالج.
مواصلة الوصول إلى Relyvrio عبر الشركة المصنعة
إذا كنت راضياً عن علاج Relyvrio الخاص بك ويرغب طبيبك في إبقائك عليه، يمكنك الاتصال بأميلكس لتشترك في برنامجهم المجاني. قد يكون هذا الخيار الأفضل لك ولن يكون له أي عواقب مالية أيضاً.
لسوء الحظ، إذا كنت تتناول دواء Relyvrio في بلد لم تتم الموافقة عليه فيه بعد (من خلال لائحة استيراد المرضى المسمين)، فقد لا ينطبق عليك البرنامج المجاني. سيتعين عليك مراجعة Amylyx ومناقشة وضعك الفردي مع الشركة.
إذا لم تكن مؤهلاً للاستفادة من البرنامج المجاني وترغب في الاستمرار في تناول دواء ريليفريو، فهناك بديل آخر يمكنك مناقشته مع طبيبك.
استبدل ريليفريو بمكوناتهAmmonaps وتودكا)
المكونات النشطة لريليفريو هي sodium phenylbutyrate وتاورورسوديول. لمواصلة العلاج بدواء ريليفريو بعد سحب الدواء من السوق، يمكنك شراء كلا المكونين النشطين وتناولهما معًا.
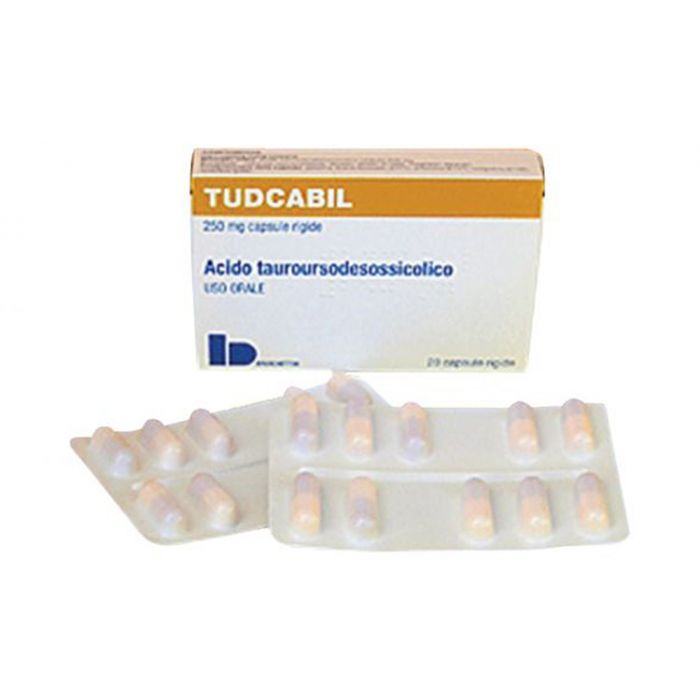
- المكون رقم 1: تودكا. يمكن شراء تورسوديول (ويسمى أيضاً tauroursodeoxycholic acid) تحت اسم تودكا أو Tudcabil. تمت الموافقة على تودكا في إيطاليا. وهو يشارك حاليًا في تجربة سريرية خاصة به لعلاج التصلب الجانبي الضموري الضموري (ALS)، حيث تم منحه تصنيف الدواء اليتيم من قبل EMA 8. لطلب Tudca خارج إيطاليا، يمكنك التواصل مع فريقنا على Everyone.org سنساعدك في شرائه واستيراده كمريض مسمى.
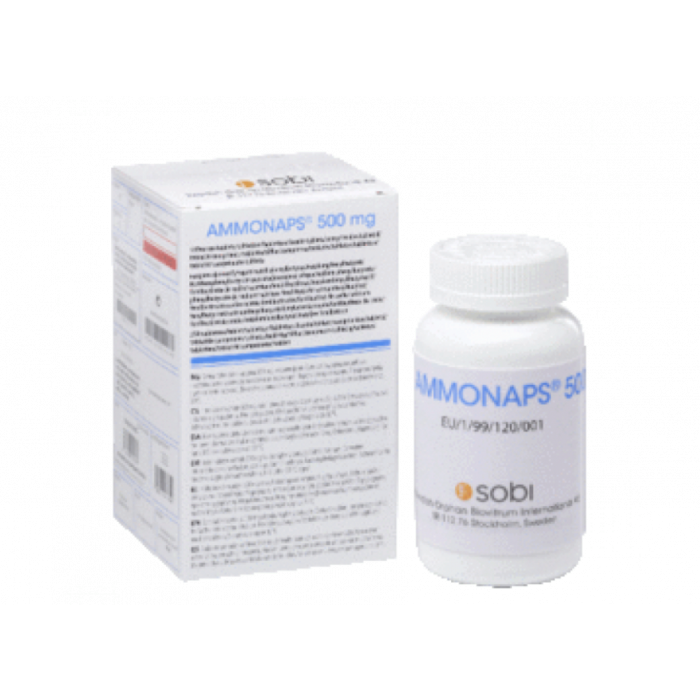
- المكون رقم 2: Ammonaps. يتوفر Sodium phenylbutyrate للشراء تحت اسم Ammonaps. تمت الموافقة عليه من قبل EMA وFDA لعلاج اضطرابات دورة اليوريا. لم تتم الموافقة عليه في أي مكان لعلاج التصلب الجانبي الضموري. ومع ذلك، يمكن لطبيبك أن يصفه لك طبيبك مع تودكا لهذا الغرض (يُعرف باسم وصفة طبية خارج التسمية). إذا كان لديك وصفة طبية، يمكننا مساعدتك في الحصول على الدواء أينما كنت.
بدائل Relyvrio الأخرى
إذا لم تكن قد بدأت علاج ريليفريو حتى الآن، أو لم تحصل على النتائج التي تريدها، فيجب عليك استكشاف بدائل أخرى. فيما يلي بعض الخيارات لبدء المناقشة مع طبيبك.
-
edaravone
يُعرف هذا الدواء أيضاً باسم راديكافا أو Radicut وهو معتمد من إدارة الغذاء والدواء الأمريكية لعلاج التصلب الجانبي الضموري. على الرغم من أن edaravone لم يحصل على موافقة EMA حتى الآن، إلا أنه يمكنك الحصول عليه من أي مكان عبر استيراد المريض المسمى. ومع ذلك، ستحتاج إلى وصفة طبية من طبيبك.
يهدف edaravone إلى إبطاء تقدم مرض التصلب الجانبي الضموري. وقد أظهرت الدراسات السريرية في اليابان أن المرضى الذين عولجوا edaravone شهدوا انخفاضًا أبطأ في القدرات الوظيفية مقارنةً بأولئك الذين يتلقون دواءً وهميًا 4.
ومع ذلك، لم تجد بعض التحليلات التلوية فرقًا ذا دلالة إحصائية في درجات القدرة الوظيفية بين المرضى edaravone edaravone والمجموعة الضابطة 5. وفيما يتعلق بنتائج البقاء على قيد الحياة، أفاد تحليل تلوي حديث بزيادة كبيرة إحصائيًا في معدلات البقاء على قيد الحياة لمرضى التصلب الجانبي الضموري الذين عولجوا edaravone مقارنةً بالمرضى الذين تم إعطاؤهم دواءً وهميًا 5.
يعود القرار فيما إذا كان هذا الدواء خياراً مناسباً لك أم لا إلى طبيبك.
-
Rilutek riluzole)
تمت الموافقة على عقار Rilutek riluzole) من قِبل إدارة الغذاء والدواء الأمريكية لعلاج التصلب الجانبي الضموري الضموري منذ عام 1995. وهو يعمل عن طريق تعديل إفراز الغلوتامات، وهو ناقل عصبي يُعتقد أنه يلعب دورًا في التنكس العصبي الذي يظهر في التصلب الجانبي الضموري. ومن خلال تقليل مستويات الغلوتامات، يهدف Rilutek إلى إبطاء تطور المرض.
يتوفر Rilutek على نطاق واسع في جميع أنحاء العالم. ومع ذلك، إذا لم يكن معتمداً أو متوفراً في بلدك، فيمكنك الحصول عليه على أي حال من خلال استيراد المرضى المسمين. تواصل مع فريقنا إذا كان لديك وصفة طبية لدواء Rilutek ولكن لا يمكنك الحصول على الدواء محلياً.
ماذا لو كان بديل Relyvrio غير متوفر في بلدك؟
يشعر مرضى التصلب الجانبي الضموري الضموري بالإحباط (بشكل مبرر) بسبب نقص خيارات العلاج المتاحة لهم. ومن المحبط بالقدر نفسه معرفة أن هناك خيارًا ولكن عليك الانتظار حتى يتوفر في بلدك.
والخبر السار هو أن أي خيار تمت الموافقة عليه في مكان ما في العالم، يمكنك الحصول عليه في أي مكان عبر استيراد المرضى الذين تمت تسميتهم. يتخصص Everyone.org في مساعدة المرضى في الحصول على العلاجات التي يحتاجونها بغض النظر عن مكان اعتمادها. إذا قرر طبيبك استبدال دواء ريليفريو بمكوناته أو تحويلك إلى edaravone أو اللجوء إلى خيار آخر، فكن مطمئنًا أنه يمكنك الحصول على العلاج الذي تحتاجه.
ما عليك سوى التواصل معنا وإرسال الوصفة الطبية الخاصة بك. سنبذل قصارى جهدنا لمساعدتك، حتى لا يؤدي إيقاف Relyvrio إلى تعطيل علاجك.
المراجع:
- لم تفي تجربة PHOENIX لتجربة AMX0035 بنقاط النهاية - جمعية التصلب الجانبي الضموري الضموري في كندا. جمعية التصلب الجانبي الضموري الضموري في كندا، 8 مارس 2024.
- ميجليو، ماركو. أميليكس تفكر في سحب AMX0035 بعد نتائج المرحلة الثالثة المخيبة للآمال من PHOENIX. NeurologyLive، 8 مارس 2024.
- تشينغ، ميرا سحب عقار Relyvrio لعلاج التصلب الجانبي الضموري الضموري من الأسواق بعد فشل التجارب السريرية. سي إن إن، تم الوصول إليه في 14 مايو 2024.
- فعاليةedaravone في التصلب الجانبي الضموري مع انخفاض القدرة الحيوية القسرية: التحليل اللاحق للدراسة 19 (MCI186-19) [التجربة السريرية NCT01492686]. NCBI، 14 يونيو 2022.
- سلامة وفعالية edaravone في المرضى الذين يعانون من التصلب الجانبي الضموري: مراجعة منهجية وتحليل تلوي. العلوم العصبية، تم الوصول إليه في 14 مايو 2024.
- نوفينز، أوليفيا، وآخرون. موافقة ريليفريو: الدروس المستفادة. باريكسيل، تم الوصول إليه في 14 مايو 2024.
- تجربة علاج التصلب الجانبي الضموري الضموري Sodium Phenylbutyrate. The New Englang Journal of Medicine، تم الوصول إليه في 14 مايو 2024.
- EU/3/17/1844 - التعيين اليتيم لعلاج التصلب الجانبي الضموري. وكالة الأدوية الأوروبية، 31 مارس 2017.